Veuillez saisir au moins 3 caractères pour votre recherche.
- Médicaments
- DRILL
- DRILL past à sucer
Sommaire
chlorhexidine gluconate solution
aromatisant : coquelicot arôme, cerise alcoolat, framboise alcoolat, cerise alcoolature, framboise alcoolature, cassis bourgeon alcoolature, cassis fruit alcoolature, vanille, amande amère essence, lie de vin essence, orange essence, rose essence, jasmin, iris, violette feuille, pulmoral arôme, menthol, eucalyptus essence, thymol, terpinéol
EEN sans dose seuil : rouge cochenille A, glucose liquide, saccharose
Cip : 3400931325703
Modalités de conservation : Avant ouverture : < 25° durant 30 mois
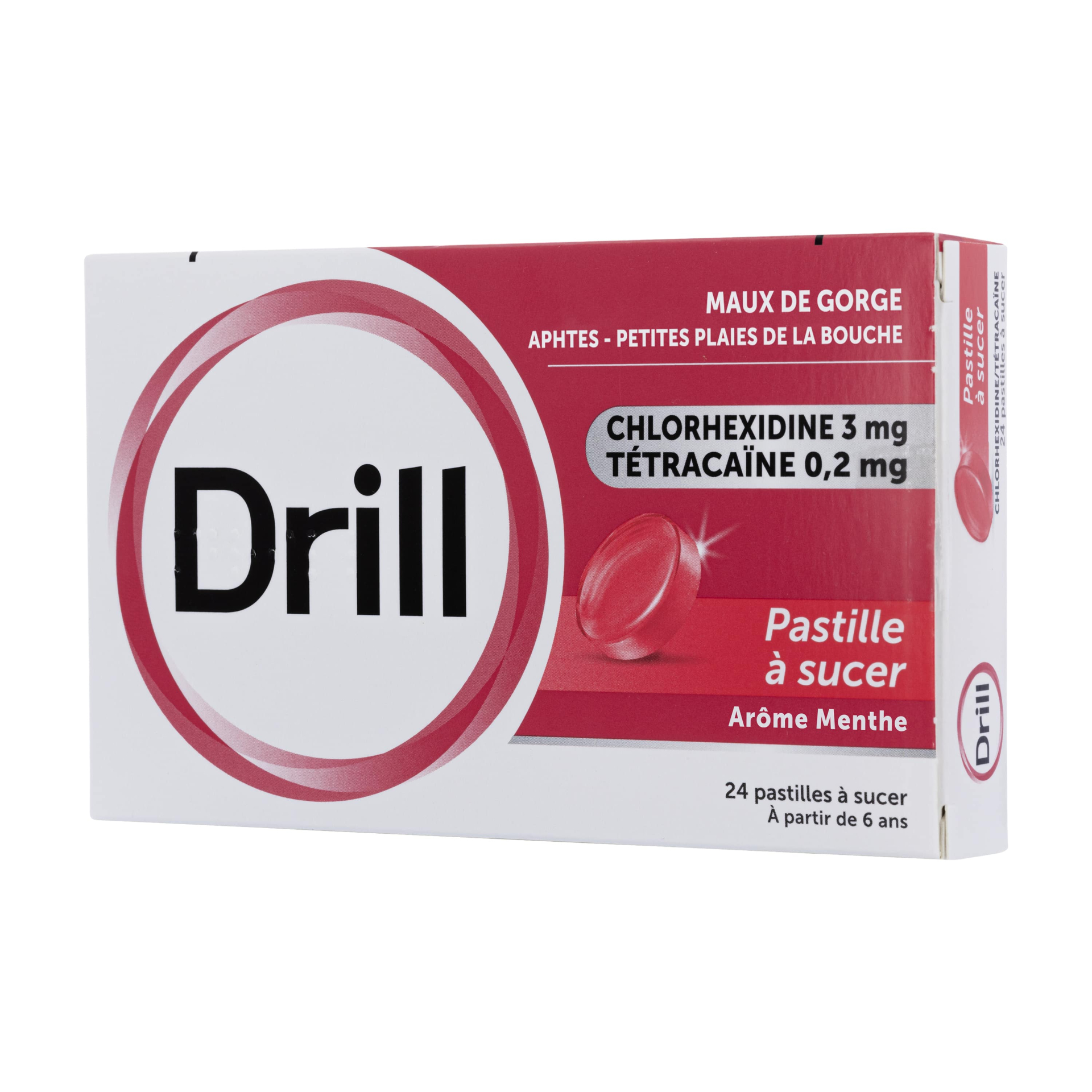
FORMES et PRÉSENTATIONS |
Pastille (ronde, de couleur rouge).
Boîte de 24, sous plaquettes thermoformées.
COMPOSITION |
Pour une pastille de 2,5 g :
Solution de digluconate de chlorhexidine à 20 pour cent (15,97 mg).
Quantité correspondant à digluconate de chlorhexidine : 3,00 mg
Chlorhydrate de tétracaïne : 0,20 mg
Excipients à effet notoire : glucose liquide (870,00 mg), rouge cochenille A (E124) (0,20 mg), saccharose (1 555,00 mg).
Acide ascorbique, arôme coquelicot 44 % Natura*, arôme pulmoral LE1444**, glycyrrhizate d'ammonium, rouge cochenille A (E124), glucose liquide, saccharose.
* Arôme coquelicot 44 % Natura : alcoolats de cerise et de framboise ; alcoolatures de cerise, de framboise, de bourgeons de cassis, de cassis fruit, de vanille ; huiles essentielles dont amande amère, lie de vin, orange, rose ; hyperconcentrés aromatiques tels que absolues et concrètes, parmi lesquels vanille, jasmin, iris, feuilles de violette, saccharose.
** Arôme pulmoral LE1444 : menthol, huile essentielle d'eucalyptus, thymol, terpinéol.
INDICATIONS |
Traitement local d'appoint antibactérien et antalgique des affections limitées à la muqueuse buccale et à l'oropharynx (en cas de mal de gorge peu intense et sans fièvre, d'aphtes et de petites plaies de la bouche).
NB : devant les signes cliniques généraux d'infection bactérienne, une antibiothérapie par voie générale doit être envisagée.
DRILL est indiqué chez les adultes et les enfants de plus de 6 ans.
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
CONTRE-INDICATIONS |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
Avertissements
Possibilité de fausse route et d'étouffement par anesthésie du carrefour oropharyngé (voir rubrique Effets indésirables) :
Risque d'allergie généralisée à la chlorhexidine, pouvant entraîner un choc anaphylactique pouvant mettre la vie en danger si des soins médicaux immédiats ne sont pas fournis. Il comprend des difficultés respiratoires, un gonflement du visage, une éruption cutanée sévère.
Si le patient développe une réaction allergique à la chlorhexidine, il doit immédiatement arrêter l'utilisation du produit et rechercher des soins médicaux appropriés (voir rubrique Effets indésirables).
L'indication ne justifie pas un traitement prolongé au-delà de 5 jours d'autant qu'il pourrait exposer à un déséquilibre de la flore microbienne normale de la cavité buccale avec un risque de diffusion bactérienne ou fongique.
Un traitement répété ou prolongé au niveau de la muqueuse peut exposer aux risques d'effets systémiques toxiques des anesthésiques de contact (atteinte du système nerveux central avec convulsions, dépression du système cardio-vasculaire).
En cas de persistance des symptômes au-delà de 5 jours et/ou de fièvre associée, la conduite à tenir devra être réévaluée.
Après la prise de ce médicament, une coloration jaune-brun de la langue peut se produire et disparaître après la fin du traitement. Une coloration des dents et du silicate ou du composite de restauration peut également se produire (voir rubrique Effets indésirables). Cette coloration n'est pas permanente et, dans la plupart des cas, peut être largement évitée en réduisant la consommation de thé, de café et de vin rouge et par un brossage quotidien avec une brosse à dents et un dentifrice classique avant d'utiliser DRILL ou, dans le cas de prothèses dentaires, par un nettoyage avec un nettoyant conventionnel de prothèse (voir rubrique Effets indésirables).
Dans les cas où un brossage normal des dents n'est pas possible, un traitement et un polissage peuvent être envisagés.
Ce médicament contient :
Précautions d'emploi
Ce produit contient des dérivés terpéniques comme excipients, qui peuvent abaisser le seuil épileptogène, en cas de doses excessives (voir rubrique Surdosage).
Ceci doit être pris en compte en cas d'antécédents d'épilepsie ou de convulsions.
Population pédiatrique
Possibilité de fausse route par anesthésie du carrefour oropharyngé : utiliser ce médicament avec précaution chez l'enfant de moins de 12 ans.
INTERACTIONS |
Connectez-vous pour accéder à ce contenu
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Grossesse
Il n'existe pas de données ou il existe des données limitées (moins de 300 grossesses) sur l'utilisation de la chlorhexidine et de la tétracaïne chez la femme enceinte.
Les études effectuées chez l'animal n'ont pas mis en évidence d'effets néfastes directs ou indirects (dans les conditions normales d'utilisation) sur la reproduction (voir rubrique Sécurité préclinique).
Par mesure de précaution, il est préférable d'éviter l'utilisation de DRILL pendant la grossesse.
Allaitement
On ne sait pas si la chlorhexidine et la tétracaïne sont excrétés dans le lait maternel.
DRILL contient des dérivés terpéniques susceptibles de passer dans le lait maternel. Un risque pour les nouveau-nés/nourrissons ne peut être exclu.
Par mesure de précaution, DRILL ne doit pas être utilisé pendant l'allaitement.
Fertilité
La chlorhexidine et la tétracaïne n'ont aucun effet sur la fertilité dans les études animales (voir rubrique Sécurité préclinique).
CONDUITE et UTILISATION DE MACHINES |
DRILL n'a aucun effet ou un effet négligeable sur l'aptitude à conduire des véhicules et à l'utilisation des machines.
EFFETS INDÉSIRABLES |
Connectez-vous pour accéder à ce contenu
SURDOSAGE |
Symptômes
Les effets mentionnés ci-dessous ne sont pas attendus dans les conditions normales d'utilisation. En cas de surdosage important (très grande quantité), les effets suivants peuvent être observés :
Ce produit contient des dérivés terpéniques comme excipients, qui peuvent abaisser le seuil épileptogène et entraîner, en cas de doses excessives, des troubles neurologiques chez l'enfant, tels que des convulsions.
Traitement
Initier un traitement symptomatique.
PHARMACODYNAMIE |
Connectez-vous pour accéder à ce contenu
PHARMACOCINÉTIQUE |
Connectez-vous pour accéder à ce contenu
SÉCURITÉ PRÉCLINIQUE |
Les données non cliniques issues des études conventionnelles de pharmacologie de sécurité, toxicologie en administration répétée, génotoxicité, cancérogenèse, et des fonctions de reproduction et de développement, n'ont pas révélé de risque particulier pour l'homme.
Des effets ont été observés chez l'animal uniquement à des expositions considérées comme suffisamment supérieures à l'exposition maximale observée chez l'homme, et ont peu de signification clinique.
Les études d'irritation oculaire et d'irritations cutanées primaires ont démontré que le produit n'est pas irritant.
DURÉE DE CONSERVATION |
30 mois.
PRÉCAUTIONS PARTICULIÈRES DE CONSERVATION |
A conserver à une température ne dépassant pas 25 °C.
PRÉCAUTIONS PARTICULIÈRES D'ÉLIMINATION ET DE MANIPULATION |
Pas d'exigences particulières.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM |
|