Veuillez saisir au moins 3 caractères pour votre recherche.
- Médicaments
- DOLIPRANE
- DOLIPRANE 2,4 % susp buv
Sommaire
aromatisant : fraise arôme, arôme naturel, huile végétale
EEN sans dose seuil : sorbitol à 70% non cristallisable, sodium benzoate
Cip : 3400934615467
Modalités de conservation : Avant ouverture : < 30° durant 24 mois
Après ouverture : < 30° durant 6 mois
FORMES et PRÉSENTATIONS |
COMPOSITION |
| par graduation de 1 kg | |
| Paracétamol | 15 mg |
La graduation maximale 13 kg correspond à 8,13 ml de suspension, soit environ 195 mg de paracétamol.
INDICATIONS |
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
CONTRE-INDICATIONS |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
A titre d'information :
Chez un enfant traité par 60 mg/kg/jour de paracétamol, l'association d'un autre antipyrétique n'est justifiée qu'en cas d'inefficacité.
L'administration de paracétamol peut exceptionnellement entraîner une toxicité hépatique, même à dose thérapeutique, après un traitement de courte durée et chez des patients sans antécédents de troubles hépatiques (cf Effets indésirables).
Le paracétamol est à utiliser avec précaution sans dépasser 3 g/jour dans les situations suivantes (cf Posologie et Mode d'administration) :La consommation de boissons alcoolisées pendant le traitement est déconseillée.
En cas de sevrage récent d'un alcoolisme chronique, le risque d'atteinte hépatique est majoré.
En cas de découverte d'une hépatite virale aiguë, il convient d'arrêter le traitement.
La prudence est conseillée lors de l'administration de flucloxacilline et de paracétamol de façon concomitante en raison du risque accru d'acidose métabolique à trou anionique élevé (AMTAE). Les patients à risque élevé d'AMTAE sont notamment ceux atteints d'insuffisance rénale sévère, de sepsis ou de malnutrition et d'autres sources de déficit en glutathion (par exemple, alcoolisme chronique), ainsi que chez ceux qui utilisent des doses quotidiennes maximales de paracétamol. Une surveillance étroite, incluant la mesure de la 5-oxoproline urinaire, est recommandée.
Chez l'enfant, la posologie devra être ajustée en fonction du poids (cf Posologie et Mode d'administration).
Excipients à effet notoire :
Ce médicament contient 500 mg/ml (312,5 mg/graduation-kg) de sorbitol.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par prise, c'est-à-dire qu'il est essentiellement « sans sodium ».
Ce médicament contient 3 mg/ml (1,88 mg/graduation-kg) de benzoate de sodium. Le benzoate de sodium peut augmenter la bilirubinémie chez les nouveau-nés (jusqu'à 4 semaines). L'augmentation de la bilirubinémie suite à son déplacement grâce à l'albumine peut accroître le risque d'ictère néonatal pouvant se transformer en ictère nucléaire (dépôts de bilirubine non conjuguée dans le tissu cérébral).
INTERACTIONS |
Connectez-vous pour accéder à ce contenu
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Les études effectuées chez l'animal n'ont pas mis en évidence d'effet tératogène ou fœtotoxique du paracétamol.
Une vaste quantité de données portant sur les femmes enceintes démontre l'absence de toute malformation ou de toute toxicité fœtale/néonatale.
Les études épidémiologiques consacrées au neurodéveloppement des enfants exposés au paracétamol in utero produisent des résultats non concluants.
Si cela s'avère nécessaire d'un point de vue clinique, le paracétamol peut être utilisé pendant la grossesse. Cependant il doit être utilisé à la dose efficace la plus faible, pendant la durée la plus courte et le moins fréquemment possible au cours de la grossesse.
Après la prise orale, le paracétamol est excrété dans le lait maternel, mais à des quantités non cliniquement significatives. A doses thérapeutiques, l'administration de ce médicament est possible pendant l'allaitement.
Fertilité :En raison du mécanisme d'action potentiel sur les cyclo-oxygénases et la synthèse de prostaglandines, le paracétamol pourrait altérer la fertilité chez la femme par un effet sur l'ovulation réversible à l'arrêt du traitement.
Des effets sur la fertilité des mâles ont été observés dans une étude chez l'animal. La pertinence de ces effets chez l'homme n'est pas connue.
EFFETS INDÉSIRABLES |
Connectez-vous pour accéder à ce contenu
SURDOSAGE |
Le risque d'une intoxication grave peut être particulièrement élevé chez les sujets âgés, chez les jeunes enfants, chez les patients avec une atteinte hépatique, en cas d'alcoolisme chronique, chez les patients souffrant de réserves basses en glutathion telles que la malnutrition chronique (cf Posologie et Mode d'administration), le jeûne, l'amaigrissement récent, le vieillissement, les virus de l'hépatite virale chronique et du VIH, la cholémie familiale (Maladie de Gilbert) ainsi que les patients traités de façon concomitante par des médicaments inducteurs enzymatiques. Dans ces cas, l'intoxication peut être mortelle.
PHARMACODYNAMIE |
Connectez-vous pour accéder à ce contenu
PHARMACOCINÉTIQUE |
Connectez-vous pour accéder à ce contenu
SÉCURITÉ PRÉCLINIQUE |
Aucune étude conventionnelle s'appuyant sur les normes actuellement admises pour évaluer la toxicité pour la reproduction et le développement n'est disponible.
MODALITÉS DE CONSERVATION |
A conserver à une température ne dépassant pas 30 °C.
MODALITÉS MANIPULATION/ÉLIMINATION |
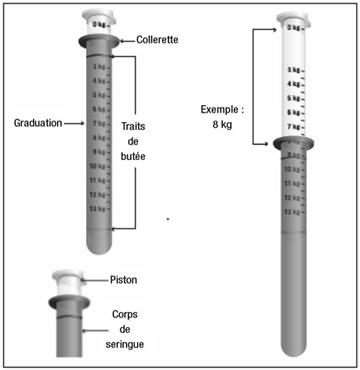 |
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM | 3400934615467 (1998, RCP rév 28.01.2025). |
| Prix : | 1,38 euros (flacon de 100 ml). |
| Remb Séc soc à 65 %. Collect. | |

Intoxications volontaires au paracétamol chez les enfants et adolescents : l'ANSM réagit