Veuillez saisir au moins 3 caractères pour votre recherche.
- Médicaments
- ADVATE
- ADVATE 1000 UI/2 ml pdre/solv p sol inj
Sommaire
excipient du solvant : eau ppi
EEN sans dose seuil : polysorbate 80
EEN avec dose seuil : sodium
Cip : 3400958720642
Modalités de conservation : Avant ouverture : < 25° durant 6 mois (A conserver à température ambiante, Conserver à l'abri de la lumière, Conserver dans son emballage), 2° < t < 8° durant 24 mois (Conserver à l'abri de la lumière, Conserver dans son emballage, Conserver au réfrigérateur, Ne pas congeler)
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
Liste I
Prescription initiale hospitalière de 6 mois.
Délivrance réservée aux pharmacies à usage intérieur des établissements de santé.
| AMM |
|
FORMES et PRÉSENTATIONS |
Poudre (friable, de couleur blanche à légèrement grise) et solvant (solution limpide et incolore) pour solution injectable.
Coffret contenant : 1 flacon de poudre + 1 flacon de 2 ml de solvant* avec système prêt à l'emploi (Baxject III) dans une plaquette scellée.
* Le flacon de poudre et le flacon de solvant sont préassemblés avec le système pour reconstitution.
COMPOSITION |
Chaque flacon contient nominalement 1 000 UI* de facteur VIII (rDNA) de coagulation humain, octocog alfa**. ADVATE contient approximativement 500 UI par ml de facteur VIII (rDNA) de coagulation humain, octocog alfa après reconstitution.
* Le titre (Unité Internationale) est déterminé par dosage chromogénique, selon la Pharmacopée européenne. L'activité spécifique d'ADVATE est d'environ 4 520-11 300 UI/mg de protéine.
** L'octocog alfa (facteur VIII de coagulation humain (rDNA)) est une protéine purifiée, qui a 2 332 acides aminés. Il est produit par la technique de l'ADN recombinant sur cellules d'ovaire de hamster chinois (CHO). Préparé sans addition de protéine (exogène) d'origine humaine ou animale lors des étapes de culture cellulaire, de purification ou de formulation finale.
Résidu de fabrication : protéines de souris et de hamster.
Excipients à effet notoire :
Ce médicament contient 0,45 mmol de sodium (10 mg) par flacon.
Poudre : mannitol, chlorure de sodium, histidine, tréhalose, chlorure de calcium, trométamol, polysorbate 80, glutathion (réduit).
Solvant : eau pour préparations injectables stérilisée.
INDICATIONS |
Traitement et prophylaxie des épisodes hémorragiques chez les patients atteints d'hémophilie A (déficit congénital en facteur VIII). ADVATE est indiqué dans tous les groupes d'âge.
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
CONTRE-INDICATIONS |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Hypersensibilité
Des réactions d'hypersensibilité de type allergique, notamment l'anaphylaxie, ont été rapportées avec ADVATE. Le produit contient des traces de protéines de souris et de hamster. En cas de survenue de symptômes d'hypersensibilité, il faut indiquer aux patients d'interrompre immédiatement l'administration du produit et de contacter leur médecin. Les patients doivent être informés des signes précoces des réactions d'hypersensibilité, y compris de l'urticaire, de l'urticaire généralisée, de l'oppression thoracique, de la respiration sifflante, de l'hypotension et de l'anaphylaxie.
En cas de choc, le traitement standard relatif à l'état de choc devra être instauré.
En raison de la baisse de volume d'injection d'ADVATE reconstitué dans 2 ml d'eau pour préparations injectables stérilisée, le temps de réaction et d'interruption de l'injection en cas de réaction d'hypersensibilité est d'autant plus court. Il est donc conseillé de faire preuve de prudence lors de l'injection d'ADVATE reconstitué dans 2 ml d'eau pour préparations injectables stérilisée, en particulier chez l'enfant.
Inhibiteurs
L'apparition d'anticorps neutralisants (inhibiteurs) du facteur VIII est une complication connue du traitement des patients atteints d'hémophilie A. Ces inhibiteurs sont habituellement des immunoglobulines IgG dirigées contre l'activité coagulante du facteur VIII et sont mesurées en Unités Bethesda par ml de plasma par le test modifié. Le risque de développer des inhibiteurs est corrélé à la gravité de la maladie ainsi qu'à l'exposition au facteur VIII, le risque étant le plus élevé au cours des 20 premiers jours d'exposition. Rarement, les inhibiteurs peuvent apparaître après les 100 premiers jours d'exposition.
Des cas de réapparition d'inhibiteurs (faible titre) ont été observés après le changement d'un facteur VIII pour un autre, chez des patients préalablement traités ayant plus de 100 jours d'exposition et qui avaient des antécédents de développement d'inhibiteur. Il est donc recommandé de surveiller attentivement tous les patients afin de détecter l'apparition d'un inhibiteur suite à un changement de produit.
La pertinence clinique de l'apparition d'inhibiteurs dépendra du titre d'inhibiteurs ; un faible titre d'inhibiteurs provisoire ou constant présente un risque de réponse clinique insuffisante moins élevé qu'un titre élevé d'inhibiteurs.
De manière générale, tous les patients traités avec des produits de facteur VIII de coagulation doivent faire l'objet d'une surveillance soigneuse pour détecter l'apparition d'inhibiteurs par un suivi clinique et à l'aide de tests biologiques appropriés. Si le taux de facteur VIII plasmatique attendu n'est pas atteint ou si l'hémorragie n'est pas contrôlée par une dose adéquate, un dosage doit être réalisé afin de rechercher la présence d'un inhibiteur du facteur VIII. Chez les patients présentant un titre élevé d'inhibiteur, le traitement en facteur VIII peut ne pas être efficace et d'autres options thérapeutiques doivent être considérées. Le suivi de tels patients doit être effectué par des médecins expérimentés dans la prise en charge de l'hémophilie et des inhibiteurs du facteur VIII.
Administration incorrecte d'ADVATE
L'administration incorrecte (par voie intra-artérielle ou hors de la veine) d'ADVATE reconstitué avec 2 ml d'eau pour préparations injectables stérilisée peut entraîner des réactions transitoires légères au niveau du site d'injection, telles que des bleus et un érythème.
Complications liées au cathéter lors du traitement
Si un dispositif d'accès veineux central (DAVC) est requis, le risque de complications liées au DAVC, notamment des infections locales, une bactériémie et une thrombose au site du cathéter, doit être pris en compte.
Considérations liées à l'excipient
Sodium
Ce médicament contient 10 mg de sodium par flacon, ce qui équivaut à 0,5 % de l'apport alimentaire quotidien maximal recommandé par l'OMS de 2 g de sodium par adulte.
Il est fortement recommandé qu'à chaque administration d'ADVATE à un patient, le nom et le numéro de lot du produit soient enregistrés afin de maintenir un lien entre le patient et le numéro de lot du médicament.
Population pédiatrique :
La liste des avertissements et des précautions s'applique aussi bien aux adultes qu'aux enfants.
INTERACTIONS |
Connectez-vous pour accéder à ce contenu
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Aucune étude de reproduction animale n'a été conduite avec le facteur VIII. En raison de la rareté de l'hémophilie A chez la femme, il n'y a pas de donnée disponible sur l'utilisation de facteur VIII lors de la grossesse ou de l'allaitement. En conséquence, le facteur VIII ne doit être utilisé pendant la grossesse ou l'allaitement qu'en cas de nécessité absolue.
CONDUITE et UTILISATION DE MACHINES |
ADVATE n'a aucun effet sur l'aptitude à conduire des véhicules et à utiliser des machines.
EFFETS INDÉSIRABLES |
Connectez-vous pour accéder à ce contenu
SURDOSAGE |
Aucun cas de surdosage suite à l'administration de facteur VIII de coagulation recombinant n'a été signalé.
PHARMACODYNAMIE |
Connectez-vous pour accéder à ce contenu
PHARMACOCINÉTIQUE |
Connectez-vous pour accéder à ce contenu
SÉCURITÉ PRÉCLINIQUE |
Les données non cliniques issues des études de pharmacologie de sécurité, toxicologie aiguë, toxicité en administration répétée, toxicité locale et génotoxicité n'ont pas révélé de risque particulier pour l'homme.
Une étude de tolérance locale chez le lapin a démontré qu'ADVATE reconstitué avec 2 ml d'eau pour préparations injectables stérilisée était bien toléré après administration intraveineuse. Une légère rougeur transitoire au site d'administration a été observée après administration intra-artérielle et après administration à proximité de la veine. Néanmoins, aucun changement histopathologique indésirable lié n'a pu être observé, ce qui corrobore la nature transitoire de ce résultat.
INCOMPATIBILITÉS |
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments ou solvants.
DURÉE DE CONSERVATION |
Deux ans.
Après reconstitution, d'un point de vue microbiologique, le produit doit être utilisé immédiatement. Cependant, la stabilité chimique et physique en cours d'utilisation a été démontrée pendant 3 heures à 25 °C.
Pendant la durée de conservation, le produit peut être conservé à température ambiante (ne dépassant pas 25 °C) pendant une période unique de 6 mois maximum. La date de fin de la période de 6 mois de conservation à température ambiante doit être indiquée sur l'emballage. Le produit ne doit pas être remis au réfrigérateur.
PRÉCAUTIONS PARTICULIÈRES DE CONSERVATION |
À conserver au réfrigérateur (entre 2 °C et 8 °C). Ne pas congeler.
Conserver la plaquette scellée dans l'emballage extérieur à l'abri de la lumière.
Pour les conditions de conservation de la solution après reconstitution, voir rubrique Durée de conservation.
PRÉCAUTIONS PARTICULIÈRES D'ÉLIMINATION ET DE MANIPULATION |
ADVATE doit être administré par voie intraveineuse après reconstitution du produit.
La solution reconstituée doit être inspectée visuellement pour mettre en évidence la présence de particules étrangères et/ou d'une coloration anormale.
Après reconstitution, la solution est limpide, incolore et exempte de particules.
Ne pas utiliser de solution trouble ou présentant des dépôts.
Reconstitution avec le système BAXJECT III
Ne pas utiliser si le couvercle n'est pas complètement scellé sur la plaquette.
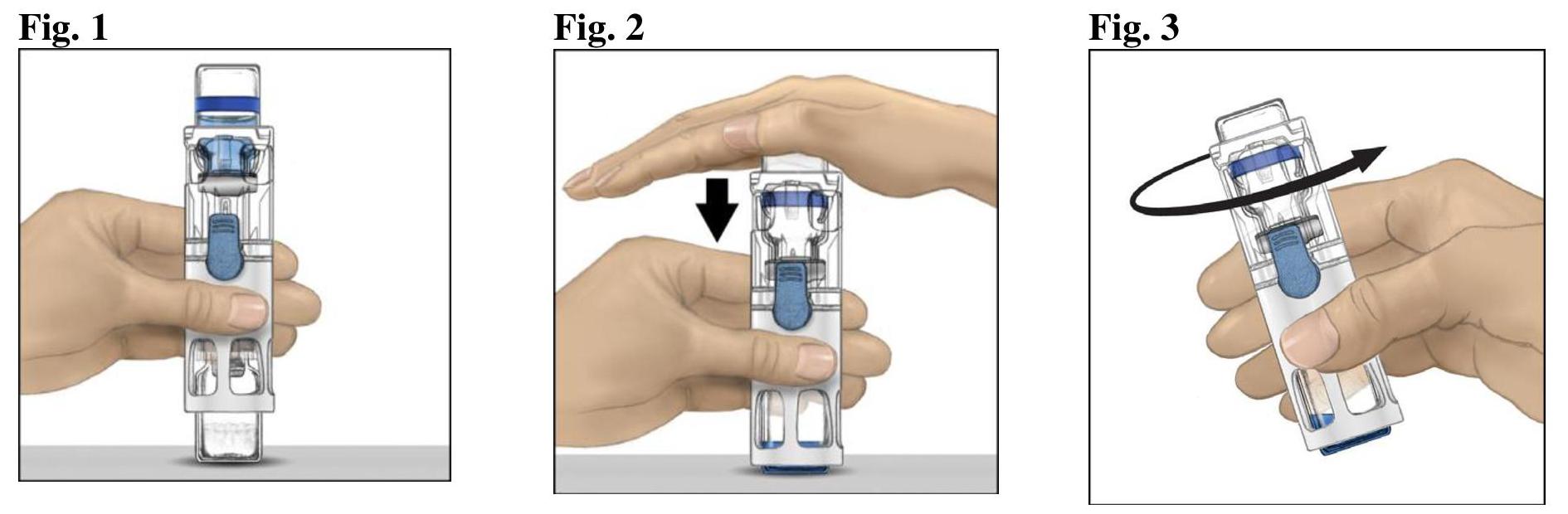
Administration
Utiliser une technique aseptique.
Avant administration, la recherche de particules en suspension doit être réalisée sur tous les médicaments injectables quand la solution et le récipient le permettent. N'utiliser la solution que si elle est limpide et incolore.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
Liste I
Prescription initiale hospitalière de 6 mois.
Délivrance réservée aux pharmacies à usage intérieur des établissements de santé.
| AMM |
|