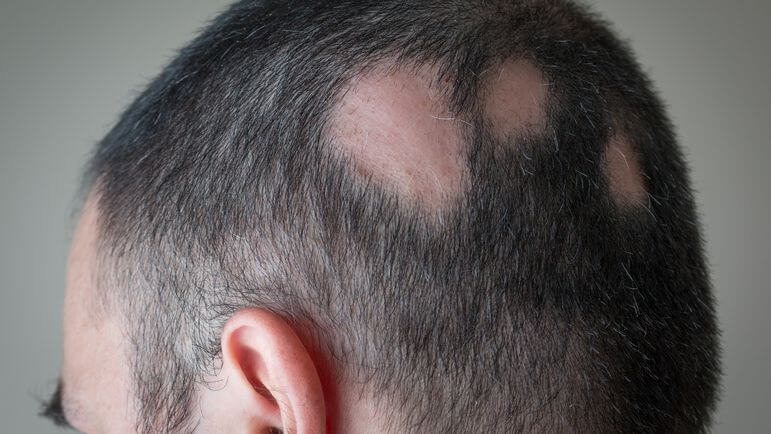
La sévérité de la pelade est évaluée à l’aide du score de SALT (Severity of Alopecia Tool).AlexPapp / iStock/Getty Images Plus / via Getty Images
OLUMIANT 2 mg et OLUMIANT 4 mg comprimé pelliculé (baricitinib) bénéficient d'une extension de prise en charge (remboursement à 65 % et agrément aux collectivités) dans le traitement de la pelade sévère de l'adulte.
OLUMIANT est le premier médicament en France à disposer de cette indication.
L'efficacité du baricitinib chez les patients souffrant de pelade sévère a été démontrée dans deux études versus placebo.
OLUMIANT est un médicament d'exception, de prescription restreinte.
L' inhibiteur de Janus kinases (JAK) OLUMIANT 2 mg et 4 mg comprimé pelliculé (baricitinib) est désormais remboursable à 65 % et agréé aux collectivités dans le traitement de la pelade sévère de l'adulte [1, 2].
L'autorisation de mise sur le marché (AMM) a été étendue à cette indication en juin 2022.
Dans son avis du 25 octobre 2023 [3], la Commission de la transparence (CT) souligne qu'OLUMIANT est la première spécialité à disposer de cette indication (pelade sévère). Elle considère qu'OLUMIANT est un traitement de 1re intention.
Comme dans les autres indications remboursables, la prise en charge d'OLUMIANT est conditionnée à :
- une ordonnance de médicament d'exception ;
- une prescription initiale hospitalière annuelle ;
- une prescription initiale et un renouvellement établis par des spécialistes en rhumatologie, en dermatologie, en médecine interne ou en allergologie.
Une supériorité démontrée versus placebo
Pour définir sa position, la CT a pris en compte les conclusions des études cliniques suivantes :
- l'étude de phase II/III JAHO (BRAVE-AA1 ; NCT03570749) ;
- l'étude de phase III JAIR (BRAVE-AA2 ; NCT03899259).
Ces études d'efficacité et de tolérance menées versus placebo pendant 36 semaines chez des patients adultes ayant une pelade sévère à très sévère ont été prolongées par des phases d’extension allant jusqu’à 200 semaines. Le score SALT (Severity of Alopecia Tool) qui permet la classification de la sévérité de la pelade a été utilisé. Pour évaluer ce score, le cuir chevelu est notamment divisé en 4 zones et le pourcentage de perte de cheveux dans chacune des quatre zones est déterminé par le clinicien. Après calcul, trois stades de sévérité sont définis : pelade légère (SALT ≤ 20 %), pelade modérée (SALT > 20 et < 50 %), pelade sévère (SALT ≥ 50 %).
Le critère de jugement principal cliniquement pertinent évaluait la repousse des cheveux sur plus de 80 % du cuir chevelu, soit un score absolu SALT ≤ 20.
Les pourcentages de patients répondeurs SALT ≤ 20 à la semaine 36 étaient similaires dans les deux études (différences versus placebo) :
- 29,9 % et 16,4 % respectivement pour le dosage 4 mg et 2 mg dans l’étude JAHO ;
- 29,9 % et 14,7 % dans l’étude JAIR.
La supériorité du baricitinib 2 et 4 mg par rapport au placebo a également été démontrée sur :
- la repousse du cuir chevelu presque complète (SALT ≤ 10), dès la semaine 24 (dans l’étude JAHO) ;
- la repousse des sourcils et des cils appréciée par le clinicien, à la semaine 36.
Le profil de tolérance du baricitinib était marqué principalement par l’augmentation des infections (rhinopharyngite ou une infection des voies aériennes supérieures principalement), des céphalées et une élévation des CPK plasmatiques.
La CT a également pris en compte le besoin médical non couvert dans le traitement de la pelade sévère.
Dans cette indication, elle a attribué à OLUMIANT :
- un service médical rendu (SMR) important ;
- une amélioration du service médical rendu (ASMR) mineure (IV).
Posologie d'OLUMIANT dans le traitement de la pelade
Dans le traitement de la pelade, la dose recommandée de baricitinib est de 4 mg 1 fois par jour, soit 1 comprimé d'OLUMIANT 4 mg par jour.
Une dose de 2 mg 1 fois par jour est recommandée pour les patients :
- à plus haut risque :
- de thromboembolie veineuse (TEV),
- d'événements indésirables cardiovasculaires majeurs (MACE),
- et de tumeurs malignes ;
- âgés de 65 ans et plus ;
- ayant des antécédents d'infections chroniques ou récurrentes.
Dans cette population particulière, une dose de 4 mg 1 fois par jour peut être envisagée pour ceux dont l'activité de la maladie est insuffisamment contrôlée avec la dose de 2 mg 1 fois par jour. La dose de 2 mg 1 fois par jour doit être envisagée pour les patients dont l'activité de la maladie est contrôlée durablement avec la dose de 4 mg 1 fois par jour et qui sont éligibles à une diminution de la dose.
Lorsqu'une réponse stable a été obtenue, il est recommandé de poursuivre le traitement pendant au moins plusieurs mois afin d'éviter une rechute, avec réévaluation régulière de la balance bénéfice/risque du traitement.
L'arrêt du traitement doit être envisagé chez les patients qui ne présentent pas de bénéfice thérapeutique après 36 semaines de traitement.
Dans son avis, la CT rappelle que les anti-JAK (dont le baricitinib) sont contre-indiqués en cas de grossesse (tératogénicité chez l'animal). Chez les femmes en âge de procréer, une contraception efficace doit être mise en place pendant le traitement et pendant 4 semaines suivant la dernière dose d'OLUMIANT.
[1] Arrêté du 25 mars 2024 modifiant la liste des spécialités pharmaceutiques remboursables aux assurés sociaux (Journal officiel du 29 mars 2024, texte 20)
[2] Arrêté du 25 mars 2024 modifiant la liste des spécialités pharmaceutiques agréées à l'usage des collectivités et divers services publics (Journal officiel du 29 mars 2024, texte 21)
[3] Avis de la Commission de la transparence - OLUMIANT et pelade (HAS, 25 octobre 2023)

 4 minutes
4 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.