La pancréatite aiguë est la principale complication du syndrome d'hyperchylomicronémie familiale qui touche près de 30 % des patients (illustration).
Résumé
WAYLIVRA 285 mg solution injectable en seringue préremplie pour injection SC (sous-cutanée) est une nouvelle spécialité indiquée dans la prise en charge d'une maladie rare, le syndrome d'hyperchylomicronémie familiale (SHCF). Cette maladie génétique héréditaire est caractérisée par une hypertriglycéridémie majeure et est associée à un risque élevé de pancréatite. WAYLIVRA est utilisé en complément d'un régime diététique hypolipidémiant.
WAYLIVRA contient un nouveau principe actif, le volanesorsen, un oligonucléotide antisens dont le mécanisme d'action repose sur l'inhibition de la production de l'apolipoprotéine C-III (apoC-III).
Dans les études, WAYLIVRA s'est montré supérieur au placebo pour réduire le taux de triglycérides (réduction de 77 % en moyenne dans le groupe volanesorsen). Cependant, la Commission de la transparence (CT) a restreint le périmètre de prise en charge de ce médicament aux seuls patients ayant un antécédent de pancréatite aiguë.
WAYLIVRA se présente sous forme de seringue préremplie, prête à l'emploi, contenant 285 mg de volanesorsen (1,5 mL de solution). Pendant les 3 premiers mois, la posologie est de 1 injection sous-cutanée (SC) par semaine (285 mg par semaine). Elle passe ensuite à une injection toutes les 2 semaines.
Une surveillance étroite des patients est nécessaire, notamment la numération plaquettaire (avant et pendant le traitement). WAYLIVRA est contre-indiqué en cas de thrombocytopénie à long terme ou inexpliquée.
De prescription hospitalière, restreinte à certains spécialistes, WAYLIVRA peut être dispensé à l'hôpital et en pharmacie de ville où l'approvisionnement est effectué par commande directe auprès du laboratoire. Il est agréé aux collectivités et remboursable à 65 %, son prix public s'élève à 10 853,38 euros TTC (boîte de 1 seringue).
WAYLIVRA 285 mg solution injectable en seringue préremplie pour injection SC (sous-cutanée) est une nouvelle spécialité indiquée dans la prise en charge d'une maladie rare, le syndrome d'hyperchylomicronémie familiale (SHCF). Cette maladie génétique héréditaire est caractérisée par une hypertriglycéridémie majeure et est associée à un risque élevé de pancréatite. WAYLIVRA est utilisé en complément d'un régime diététique hypolipidémiant.
WAYLIVRA contient un nouveau principe actif, le volanesorsen, un oligonucléotide antisens dont le mécanisme d'action repose sur l'inhibition de la production de l'apolipoprotéine C-III (apoC-III).
Dans les études, WAYLIVRA s'est montré supérieur au placebo pour réduire le taux de triglycérides (réduction de 77 % en moyenne dans le groupe volanesorsen). Cependant, la Commission de la transparence (CT) a restreint le périmètre de prise en charge de ce médicament aux seuls patients ayant un antécédent de pancréatite aiguë.
WAYLIVRA se présente sous forme de seringue préremplie, prête à l'emploi, contenant 285 mg de volanesorsen (1,5 mL de solution). Pendant les 3 premiers mois, la posologie est de 1 injection sous-cutanée (SC) par semaine (285 mg par semaine). Elle passe ensuite à une injection toutes les 2 semaines.
Une surveillance étroite des patients est nécessaire, notamment la numération plaquettaire (avant et pendant le traitement). WAYLIVRA est contre-indiqué en cas de thrombocytopénie à long terme ou inexpliquée.
De prescription hospitalière, restreinte à certains spécialistes, WAYLIVRA peut être dispensé à l'hôpital et en pharmacie de ville où l'approvisionnement est effectué par commande directe auprès du laboratoire. Il est agréé aux collectivités et remboursable à 65 %, son prix public s'élève à 10 853,38 euros TTC (boîte de 1 seringue).
La spécialité WAYLIVRA 285 mg solution injectable en seringue préremplie pour injection sous-cutanée (SC) est indiquée en complément d'un régime diététique chez les patients adultes atteints d'un syndrome d'hyperchylomicronémie familiale (SHCF - cf. Encadré 1) génétiquement confirmé et à risque élevé de pancréatite, chez qui la réponse aux mesures diététiques et à un traitement de réduction des triglycérides a été insuffisante.
Le principe actif de WAYLIVRA est le volanesorsen.
En France, WAYLIVRA a bénéficié d'une autorisation temporaire d'utilisation (ATU) dès avril 2019 (ATU nominative, puis de cohorte).
Une autorisation de mise sur le marché (AMM) européenne et conditionnelle a été octroyée à ce médicament en mai 2019.
WAYLIVRA peut être dispensé en pharmacie de ville. Le pharmacien doit commander le médicament directement au laboratoire.
WAYLIVRA fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
Encadré 1 - L'hyperchylomicronémie familiale en synthèse
| L'hyperchylomicronémie familiale est une maladie héréditaire (transmission autosomique récessive) rare (1/100 000 selon Orphanet), également dénommée déficit familial en lipoprotéine lipase (LPL) ou hyperlipoprotéinémie de type 1. Elle est caractérisée par une hypertriglycéridémie majeure, du fait d'une mutation sur le gène de la lipoprotéine lipase (LPL, enzyme dégradant les triglycérides contenus dans les chylomicrons qui les transportent). La mutation peut également porter sur un gène codant pour l'un des cofacteurs indispensables au fonctionnement de la LPL. La pancréatite aiguë est la principale complication de cette maladie, et touche près de 3 patients sur 10. |
Un nouveau principe actif : le volanesorsen
Le volanesorsen est un oligonucléotide antisens (fragment d'ARN de synthèse modifiant l'ARNm). Il agit en inhibant la production de l'apolipoprotéine C-III (apoC-III), qui joue un rôle essentiel dans le transport et la régulation du taux plasmatique de triglycérides.
Ce mécanisme d'action induirait une dégradation des triglycérides par la voie indépendante des LPL (lipoprotéine-lipases).
Évaluation médico-économique de WAYLIVRA
Dans son avis du 19 février 2020, la Commission de la transparence (CT) a attribué un service médical rendu (SMR) important et une amélioration du service médical rendu mineure (ASMR IV) à WAYLIVRA, uniquement chez les patients atteint de SHCF avec un antécédent de pancréatite aiguë.
Le SMR est considéré insuffisant en l'absence d'antécédent de pancréatite aiguë.
Données d'efficacité du volanesorsen
L'efficacité et la tolérance de WAYLIVRA ont principalement été évaluées dans les études suivantes :
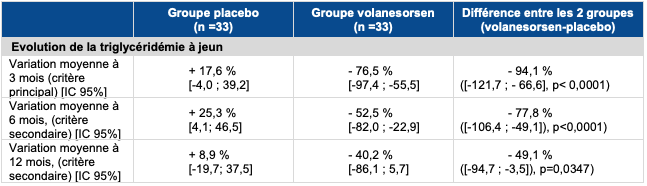
- l'étude de phase III, de supériorité, randomisée versus placebo, en double aveugle, multicentrique APPROACH (ou CS6) [1], dont le critère de jugement principal était l'évolution de la triglycéridémie à jeun après 3 mois de traitement. La supériorité de WAYLIVRA a été démontrée avec une réduction du taux de triglycérides de l'ordre de 77 %, soit une baisse de 94 % par rapport au placebo (cf. Tableau I);
- l'étude de suivi APPROACH OLE (ou CS7), avec un suivi porté à 52 semaines complémentaires. Cette étude était toujours en cours au moment de l'évaluation de WAYLIVRA.
Tableau I - Critères de jugement principal et critères de jugements secondaires hiérarchisés sur l'évolution de la triglycéridémie à jeun dans population ITTm
Concernant le profil de tolérance, il a été observé dans l'étude APPROACH une diminution de la numération plaquettaire chez 30 % des patients dans le groupe volanesorsen (10/33) versus un seul patient dans le groupe placebo.
Le profil de tolérance de WAYLIVRA nécessite donc un suivi de la numération plaquettaire pour adapter le traitement et prévenir la survenue de thrombocytopénies.
Ce risque est considéré comme important dans le plan de gestion des risques (PGR) de WAYLIVRA (cf. Tableau II).
Tableau II - Résumé des risques du PGR (version 1.8 du 28 février 2019) de WAYLVIRA

WAYLIVRA dans la stratégie thérapeutique : un traitement de première intention, chez les patients avec antécédent de pancréatite aiguë
Selon la CT, la population cible de WAYLIVRA en France est estimée au maximum à 50 patients.
Elle note par ailleurs que :
- le besoin médical n'est pas couvert dans cette maladie rare. Le traitement du SHCF repose actuellement sur un régime pauvre en graisses avec 15 à 20 g de graisse par jour, à vie ;
- les patients ayant déjà eu des pancréatites sont plus à risque d'avoir à nouveau une pancréatite aiguë ;
- l'hypertriglycéridémie majeure est associée à des comorbidités.
WAYLIVRA en pratique
Encadrement de l'initiation du traitement
Selon le résumé des caractéristiques du produit (RCP), le traitement par WAYLIVRA doit être initié, et rester supervisé, par un médecin expérimenté dans le traitement du SHCF.
Pour la Haute Autorité de santé (HAS) (avis du 19 février 2020), la décision d'instaurer le traitement par WAYLIVRA doit être prise lors de réunions de concertation pluridisciplinaires au sein du centre de référence des maladies rares du pancréas (PaRaDis) ou à défaut au sein d'une réunion de concertation pluridisciplinaire émanant de la Nouvelle Société francophone d'athérosclérose (NSFA).
Conduite à tenir avant d'instaurer WAYLIVRA
Avant l'instauration du traitement par WAYLIVRA :
- les causes secondaires d'hypertriglycéridémie (par exemple, diabète non contrôlé, hypothyroïdie) doivent être exclues ou traitées de façon appropriée ;
- le patient doit suivre un régime alimentaire hypolipidémiant ;
- une numération plaquettaire doit être réalisée. Le traitement ne doit pas être initié chez les patients atteints de thrombocytopénie (numération plaquettaire < 140 x 109/L).
Une seringue préremplie de WAYLIVRA contient 1,5 mL de solution prête à l'emploi, soit 285 mg de volanesorsen correspondant à la dose initiale recommandée.
L'injection est réalisée par voie SC en alternant les sites (abdomen, région supérieure de la cuisse ou région externe du bras) :
- 1 fois par semaine pendant les 3 premiers mois,
- puis toutes les 2 semaines.
Le traitement doit être interrompu chez les patients présentant une réduction du taux de triglycérides sériques < 25 % ou chez qui il n'a pas été possible d'atteindre un taux de triglycérides sériques inférieur à 22,6 mmol/L après 3 mois sous volanesorsen à raison de 285 mg par semaine.
Conseils pour l'administration
Qu'elle soit hebdomadaire ou quinzomadaire (toutes les 2 semaines), l'injection doit être réalisée le même jour de la semaine.
Chaque seringue préremplie est à usage unique et prête à l'emploi (l'aiguille est protégée par un capuchon).
La seringue préremplie doit être sortie du réfrigérateur (entre 2 °C et 8 °C) au moins 30 minutes avant utilisation.
Surveillance des patients : numération plaquettaire toutes les 2 semaines au moins
Après l'instauration du traitement, la surveillance du patient doit porter sur :
- le taux de plaquettes : dosage au moins toutes les 2 semaines, afin de dépister une thrombocytopénie. Si nécessaire, en fonction du taux de plaquettes, un ajustement de la dose et de la surveillance, ou un arrêt provisoire ou définitif du traitement, doivent être envisagés ;
- les enzymes hépatiques et la bilirubine sériques : suivi tous les 3 mois, afin d'identifier une éventuelle hépatotoxicité ;
- les signes de néphrotoxicité : suivi trimestrielle par un test de routine par bandelette urinaire. En cas d'évaluation positive, un bilan rénal plus complet doit être réalisé (créatininémie, protéinurie sur 24 heures, clairance de la créatinine).
Liste I
Prescription hospitalière réservée aux spécialistes et services de cardiologie, endocrinologie et hépato/gastroentérologie
Boîte de 1 seringue préremplie de 1,5 mL, CIP 3400930181966
Remboursable à 65 % (cf. Encadré 1 - Journal officiel du 9 novembre 2021 - texte 17)
Prix public TTC = 10 853,38 euros TTC
Agrément aux collectivités (cf. Encadré 1 - Journal officiel du 9 novembre 2021 - texte 18)
Laboratoire SOBI (Swedish Orphan Biovitrum)
Encadré 1 - Périmètre de prise en charge de WAYLIVRA
| Patients ayant un syndrome d'hyperchylomicronémie familial (SHCF) génétiquement confirmé, chez des patients avec un antécédent de pancréatite aiguë pour qui la réponse au régime alimentaire et au traitement visant à réduire les triglycérides a été insuffisante. |
Pour aller plus loin
Avis de la Commission de la transparence - WAYLIVRA (HAS, 19 février 2020)
L'étude pivot :
(1) Witztum JL, Gaudet D et al. Volanesorsen and triglyceride levels in familial chylomicronemia syndrome. NEJM 2019; 381: 531-42.
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 7 minutes
7 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.