Représentation en 3D de deux sortes d’anticorps monoclonaux se liant à des sites antigéniques différents de la protéine spike du coronavirus dans le but de conférer une protection synergique contre le SARS-CoV-2 (illustration).
Résumé
La bithérapie d'anticorps monoclonaux CASIRIVIMAB/IMDEVIMAB 120 mg/mL solution à diluer pour perfusion intraveineuse (RONAPREVE), fait l'objet de 2 informations majeures, adressées aux professionnels de santé utilisant ce médicament :
La bithérapie d'anticorps monoclonaux CASIRIVIMAB/IMDEVIMAB 120 mg/mL solution à diluer pour perfusion intraveineuse (RONAPREVE), fait l'objet de 2 informations majeures, adressées aux professionnels de santé utilisant ce médicament :
- il existe un risque d'erreur médicamenteuse, de type erreur de dose lors de l'administration. Cette erreur est liée à la confusion entre les volumes des contenants (flacon) et du contenu (solution à diluer),
- la posologie pour traiter les patients COVID-19 positifs ne nécessitant pas d'oxygénothérapie est modifiée : elle est désormais de 600 mg de casirivimab et 600 mg d'imdevimab en dose unique, par perfusion intraveineuse.
Deux informations du laboratoire Roche, en accord avec l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) ont été communiquées aux professionnels de santé utilisant la bithérapie CASIRIVIMAB/IMDEVIMAB 120 mg/mL solution à diluer pour injection intraveineuse (IV) ou solution pour injection sous-cutanée (SC) à base d'anticorps monoclonaux (cf. Tableau I) :
- une alerte sur le risque d'erreur médicamenteuse rapporté avec ce médicament,
- une modification de la posologie en traitement curatif, chez les patients ne nécessitant pas d'oxygène.
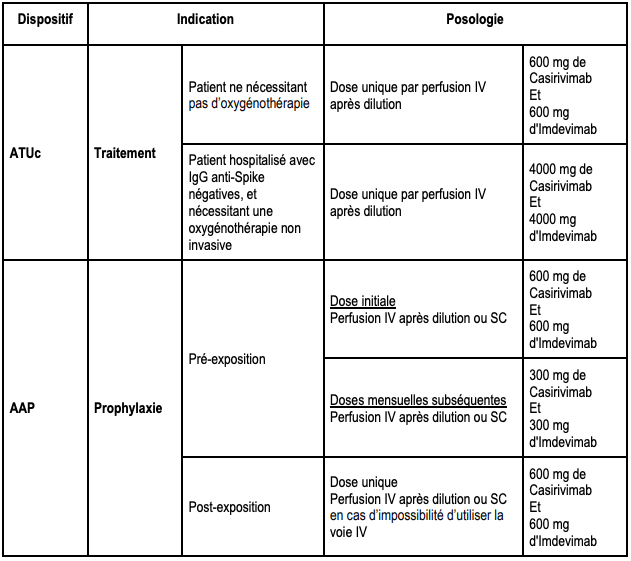
Tableau I - Indications thérapeutiques autorisées en France pour l'association CASIRIVIMAB/IMDEVIMAB (RONAPREVE), en ATUc* et en AAP**
| Traitement de la COVID-19 (ATUc) |
Traitement de la COVID-19 confirmée par un test virologique de détection du SARS-CoV-2 positif, chez les patients âgés de 12 ans et plus :
|
| Prévention de la COVID-19 (AAP) |
Ou les patients séronégatifs après un schéma vaccinal complet ou non éligibles à la vaccination et qui présentent une immunodépression sévère et qui sont à haut risque de forme sévère de la COVID-19. |
**AAP : autorisation d'accès précoce
Risque d'erreur médicamenteuse : différencier les volumes des contenants et des contenus
Des cas d'erreur médicamenteuse, correspondant à des erreurs de dose lors de l'administration, ont été rapportés avec l'association CASIRIVIMAB/IMDEVIMAB (cf. Figure 1).
Figure 1 - Visuels des différents flacons (extrait de la lettre aux professionnels de santé du 30 novembre 2021)
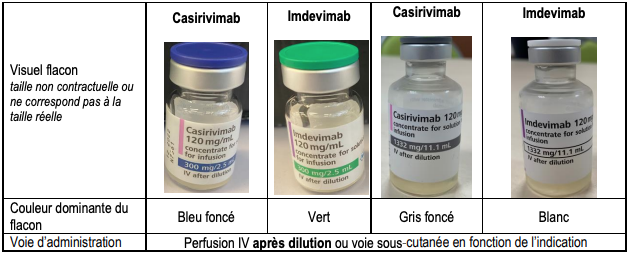
Pour rappel :
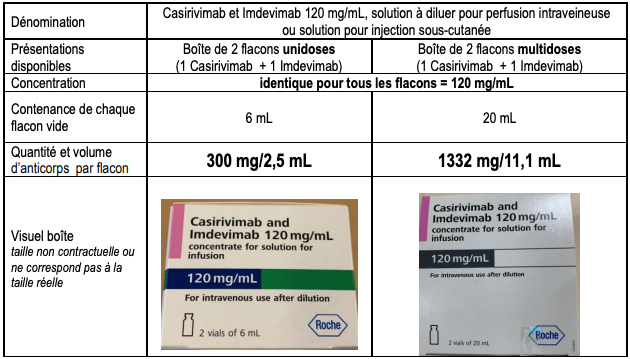
- 1 flacon multidose de 20 mL contient 11,1 mL de solution, soit 1 332 mg d'un anticorps dans 11,1 mL : 1 332 mg/11,1 mL (équivalent à 120 mg/mL), et non 1 332 mg/20 mL ;
- 1 flacon unidose de 6 mL contient 2,5 mL de solution, soit 300 mg d'un anticorps dans 2,5 mL : 300 mg/2,5 mL (équivalent à 120 mg/mL), et non 300 mg/6 mL.
Tableau II - Volumes des contenants et des contenus des flacons de casirivimab et d'imdevimab (extrait de la lettre aux professionnels de santé du 30 novembre 2021)
Traitement curatif des patients non oxygéno-requérants : modification de la posologie
Pour le traitement curatif chez les patients non oxygénoréquérants (cf. Tableau I), la posologie recommandée est désormais la suivante (cf. Tableau III) :
- une dose unique de 600 mg de casirivimab et de 600 mg d'imdevimab administrés par voie IV.
Les documents relatifs à CASIRIVIMAB/IMDEVIMAB (PTU de l'ATUc, RCP et notice) ont été actualisés le 30 novembre 2021 pour mentionner ce nouveau schéma posologique.
Tableau III - Récapitulatif des posologies et voie d'administration de casirivimab et d'imdevimab (extrait de la lettre aux professionnels de santé du 30 novembre 2021)
RONAPREVE (CASIRIVIMAB/IMDEVIMAB) a reçu un avis positif pour une AMM européenne le 12 novembre 2021, dans les indications suivantes (cf. RCP européen de RONAPREVE) :
- traitement de la COVID-19 chez l'adulte et l'adolescent à partir de 12 ans et pesant au moins 40 kg, ne nécessitant pas d'oxygénothérapie et présentant un risque accru d'évolution vers une forme sévère de la COVID-19,
- prévention de la COVID-19 chez les adultes et adolescents âgés de 12 ans et plus, pesant au moins 40 kg.
Cependant, les dispositions prévues dans cette AMM européenne ne s'appliquent pas à ce jour en France. Seuls ces documents établis dans le cadre de l'ATUc et des AAP et disponibles en ligne sur le site de l'ANSM doivent être consultés en support de l'utilisation de CASIRIVIMAB/IMDEVIMAB, dans l'attente du réexamen du dossier de demande de prise en charge par la Haute Autorité de Santé (HAS).
De même, il est demandé aux utilisateurs de CASIRIVIMAB/IMDEVIMAB de ne pas tenir compte des notices en langue anglaise fournies avec les flacons actuellement distribués en France. Ces notices ne contiennent pas toutes les informations correspondant aux indications de l'ATUc et des AAP françaises.
Pour aller plus loin
Bithérapie Casirivimab et Imdevimab (Ronapreve) : risque d'erreur médicamenteuse et modification de la posologie pour le traitement de la Covid-19 (ANSM, 30 janvier 2021)
Lettre aux professionnels de santé des services hospitaliers, HAD et PUI (sur le site de l'ANSM, 30 novembre 2021)
Sur VIDAL.fr
COVID-19 : RONAPREVE AUTORISÉ EN ACCÈS PRÉCOCE CHEZ LES PATIENTS HOSPITALISÉS ET SÉRONÉGATIFS (8 septembre 2021)
Pour aller plus loin
Consultez les monographies VIDAL
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 4 minutes
4 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.