La sclérose en plaques (SEP) est une maladie chronique inflammatoire démyélinisante du système nerveux central (illustration).
Résumé :
KESIMPTA 20 mg solution injectable en stylo prérempli (ofatumumab) est une nouvelle spécialité indiquée dans le traitement des patients adultes atteints de formes actives de sclérose en plaques récurrente (SEP-R) définies par des paramètres cliniques ou d'imagerie.
KESIMPTA est le premier anticorps monoclonal anti-CD20 mis à disposition en ville, en plus de l'hôpital, dans le traitement de la SEP ; il est remboursable à 65 % (prix public TTC = 1 644,91 euros la boîte de 1 stylo) et agréé aux collectivités.
Le schéma posologique comporte deux phases :
KESIMPTA se présente en stylo prérempli prêt à l'emploi (stylo Sensoready), délivrant 20 mg d'ofatumumab par injection.
Une surveillance des patients doit être mise en place pendant le traitement.
La prescription de KESIMPTA doit être établie par des spécialistes en neurologie.
KESIMPTA 20 mg solution injectable en stylo prérempli (ofatumumab) est une nouvelle spécialité indiquée dans le traitement des patients adultes atteints de formes actives de sclérose en plaques récurrente (SEP-R) définies par des paramètres cliniques ou d'imagerie.
KESIMPTA est le premier anticorps monoclonal anti-CD20 mis à disposition en ville, en plus de l'hôpital, dans le traitement de la SEP ; il est remboursable à 65 % (prix public TTC = 1 644,91 euros la boîte de 1 stylo) et agréé aux collectivités.
Le schéma posologique comporte deux phases :
- la phase d'initiation : 1 injection sous-cutanée (SC) par semaine (20 mg) aux semaines 0, 1 et 2,
- la phase d'entretien : à partir de la semaine 4, 1 injection SC mensuelle.
KESIMPTA se présente en stylo prérempli prêt à l'emploi (stylo Sensoready), délivrant 20 mg d'ofatumumab par injection.
Une surveillance des patients doit être mise en place pendant le traitement.
La prescription de KESIMPTA doit être établie par des spécialistes en neurologie.
L'arsenal thérapeutique de la sclérose en plaques compte une nouvelle spécialité, KESIMPTA 20 mg solution injectable en stylo prérempli, indiquée dans le traitement des patients adultes atteints de formes actives de sclérose en plaques récurrente (SEP-R - cf. Encadré 1) définies par des paramètres cliniques ou d'imagerie (cf. VIDAL Reco "Sclérose en plaques").
Encadré 1 - SEP-R : un groupe qui recouvre plusieurs entités
Selon les recommandations de l'Agence européenne du médicament (EMA), les SEP récurrentes (SEP-R) regroupent :
|
KESIMPTA fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté.
Ofatumumab : premier anticorps monoclonal anti-CD20 disponible en ville dans la SEP-R
L'ofatumumab est un anticorps monoclonal qui cible les lymphocytes B exprimant le CD20 (anti-CD20), induisant ainsi une déplétion des lymphocytes exprimant cet antigène de surface.
Les anticorps monoclonaux sont utilisés dans d'autres domaines thérapeutiques, dont l'oncologie/hématologie ou la rhumatologie (rituximab).
En France, l'ofatumumab est le premier anticorps monoclonal anti-CD20 mis à disposition en ville en neurologie, dans le traitement de la SEP. Dans cette indication, un autre anticorps monoclonal anti-CD20, l'ocrélizumab (OCREVUS 300 mg solution à diluer pour perfusion), est commercialisé depuis février 2018 mais disponible uniquement à l'hôpital.
Évaluation del'efficacité et de la tolérance de l'ofatumumab
Dans son avis du 2 juin 2021, la Commission de la Transparence (CT) a évalué la demande de prise en charge de KESIMPTA sur la base principalement de deux études de phase III, multicentriques, en double aveugle, randomisées versus tériflunomide (AUBAGIO), dont l'objectif principal était d'évaluer la réduction du taux annualisé de poussées sur une année chez des patients atteints de SEP-R :
- ASCLEPIOS I (NCT027922218) (1),
- ASCLEPIOS II (NCT02792231).
Selon les résultats de ces études, la supériorité de l'ofatumumab (KESIMPTA) a été démontrée par rapport au tériflunomide sur plusieurs critères de jugement :
- en termes de réduction du taux annualisé de poussée (TAP - critère de jugement principal), avec une réduction cliniquement pertinente de 50,5 % (IC95 % = [0,374 ; 0,654], p < 0,001) dans l'étude ASCLEPIOS I et de 58,5 % (IC95 % = [0,308 ; 0,559], p < 0,001) dans l'étude ASCLEPIOS II ;
- en termes de réduction d'aggravation du handicap confirmée à 3 mois (HR = 0,66, IC95 % = [0,50 ; 0,86], p = 0,002) et à 6 mois (HR = 0,68 ; IC95 % = [0,50 ; 0,92], p = 0,012) (critères secondaires hiérarchisés, analysés de façon groupée dans les deux études).
SMR important, ASMR modérée
Sur la base des données disponibles, la CT a attribué à KESIMPTA :
- un service médical rendu (SMR) important dans l'indication de l'autorisation de mise sur le marché (AMM) ;
- une amélioration du SMR modérée (ASMR III) versus tériflunomide (AUBAGIO) chez les patients atteints de SEP-RR à un stade précoce en termes de durée de la maladie et d'activité inflammatoire ; en revanche, la CT estime que KESIMPTA n'apporte pas d'ASMR en cas de SEP-R très active ou sévère.
Outre les données d'efficacité issues des études ASCLEPIOS I et II, la CT a tenu compte des éléments suivants :
- "l'absence de données robustes de comparaison aux alternatives disponibles en 1re intention, dont les autres anti-CD20, rituximab et ocrelizumab, ce dernier ayant fait l'objet d'un développement concomitant ;
- l'absence de démonstration d'une différence sur le critère d'amélioration confirmée du handicap à 6 mois versus tériflunomide (3e critère de jugement secondaire hiérarchisé dans l'analyse groupée) ;
- l'absence de données robustes versus tériflunomide sur la qualité de vie, dans une maladie qui entraîne une invalidité progressive des patients ;
- l'absence de données sur la tolérance à long terme".
La CT souhaite qu'une collecte de données observationnelles soit mise en place afin de documenter l'efficacité et la tolérance à long terme de KESIMPTA pour lesquelles persistent des incertitudes. KESIMPTA sera réévalué dans une délai maximal de 3 ans à compter de la date de l'avis de la CT (2 juin 2021).
KESIMPTA, un traitement de 1re ou 2e intention dans la SEP-R
En conclusion de son avis, la CT place KESIMPTA dans la stratégie thérapeutique de la SEP-est celle d'un traitement de première ou seconde intention dans toutes les formes actives de sclérose en plaques récurrentes à savoir SEP-RR ou SEP secondairement progressive avec poussées.
KESIMPTA en pratique
Le traitement par KESIMPTA doit être instauré par un médecin expérimenté dans la gestion des maladies en neurologie.
La dose recommandée d'ofatumumab est de 20 mg par injection SC. Le schéma posologique comporte (cf. Tableau I) :
- une phase d'initiation avec une dose de 20 mg aux semaines 0, 1 et 2,
- une phase d'entretien, avec une dose mensuelle à partir de la semaine 4.
Tableau I - Schéma posologique d'initiation et d'entretien - KESIMPTA
| Initiation de traitement | Dose à injecter |
| Semaine 0 (premier jour de traitement) | 20 mg |
| Semaine 1 | 20 mg |
| Semaine 2 | 20 mg |
| Semaine 3 | - |
| Semaine 4 | 20 mg |
| Traitement d'entretien | Dose à injecter |
| 1 dose par mois | 20 mg |
Les sites d'injection recommandés sont l'abdomen (en excluant la zone autour du nombril), la cuisse et la partie supérieure externe du bras.
Stylo prérempli KESIMPTA : consignes de manipulation
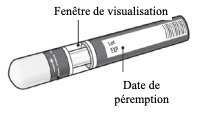 Le stylo prérempli KESIMPTA (technologie Sensoready) est prêt à l'emploi et à usage unique.
Le stylo prérempli KESIMPTA (technologie Sensoready) est prêt à l'emploi et à usage unique.Il permet d'injecter 20 mg d'ofatumumab en 1 fois.
Il est muni d'une fenêtre de visualisation, qui permet :
- avant l'injection, de contrôler l'apparence de la solution injectable,
- après l'injection, de confirmer que le produit a été injecté. La fenêtre devient verte.
Avant l'injection, le stylo prérempli doit être sorti du réfrigérateur pendant environ 15 à 30 minutes afin de l'amener à température ambiante.
Une fois le stylo en place contre la peau, le début de l'injection est annoncé par un clic sonore. Un second clic indique que l'injection est presque finie. Après le deuxième clic, le patient doit maintenir le stylo en position d'injection jusqu'à ce que l'indicateur vert remplisse la fenêtre et ne bouge plus.
Stylo prérempli KESIMPTA : consignes de conservation
Le stylo prérempli KESIMPTA doit être conservé au réfrigérateur entre 2 et 8 °C, dans l'emballage extérieur, à l'abri de la lumière.
Il doit être conservé dans l'emballage d'origine jusqu'au dernier moment, avant l'utilisation.
Modalités de surveillance des patients
Pendant le traitement par KESIMPTA, la surveillance porte sur les éléments suivants :
- signes (symptômes cliniques ou observations par IRM) de leucoencéphalopathie multifocale progressive (LEMP). En cas de suspicion de LEMP, le traitement par ofatumumab doit être interrompu jusqu'à ce que la LEMP soit exclue ;
- signes de réactivation du virus de l'hépatite B (VHB). Un dépistage du VHB doit être effectué chez tous les patients avant l'instauration du traitement.
Identité administrative
- Liste I
- Prescription réservée aux spécialistes en neurologie
- Surveillance particulière pendant le traitement
- Boîte de 1 stylo de 0,4 mL, CIP 3400930226971
- Remboursable à 65 % (Journal officiel du 2 septembre 2021, texte 35)
- Prix public TTC = 1 644,91 euros
- Agrément aux collectivités (Journal officiel du 2 septembre 2021, texte 36)
- Laboratoire Novartis
Pour aller plus loin
Avis de la Commission de la Transparence - KESIMPTA (HAS, 2 juin 2021)
Les études pivots
(1) Hauser, SL, Bar-Or A et al. Ofatumumab versus teriflunomide in multiple sclerosis. N Engl J Med 202 : 383 ; 546–57
(2) Samjoo IA et al J. Comparison of ofatumumab and other disease-modifying therapies for relapsing multiple sclerosis: a network meta-analysis. Journal of comparative effectiveness research 2020 ; 9 (18) : 1255-1274
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 6 minutes
6 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.