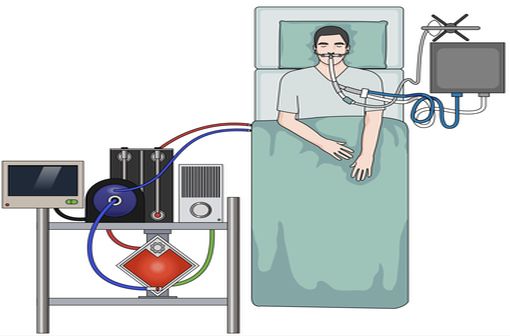
Une technique d'assistance respiratoire qui ne peut être mise en place que par des équipes spécialisées (illustration).
Résumé :
Les formes graves de la COVID-19, en particulier respiratoires, ont justifié le recours à une réanimation lourde, longue, difficile. La ventilation artificielle invasive a souvent été mise en échec.
L'oxygénation extracorporelle (ou ECMO pour Extra-Corporeal Membrane Oxygenation) est devenue possible depuis plus de vingt ans, mais son indication doit être soigneusement discutée ; elle ne peut s'envisager que par des unités spécialisées, équipées, entraînées, alors que l'assistance peut durer plusieurs semaines.
Il est clair qu'elle a permis, depuis le début de l'épidémie, de sauver de nombreuses vies, au prix d'une mortalité de l'ordre de 30 %.
Le Pr Alain Cariou nous fait part ici des principes de l'ECMO, et de son expérience au centre de Médecine Intensive et Réanimation, à l'Hôpital Cochin.
Dans les formes très sévères de syndrome de détresse respiratoire aiguë (SDRA) provoquées par l'infection à SARS-CoV-2, les lésions pulmonaires sont souvent diffuses et aboutissent, en quelques jours, à une atteinte majeure des surfaces d'échanges gazeux ( cf. Figure 1).
Au stade ultime de sévérité, les techniques conventionnelles de ventilation mécanique (intubation trachéale, sédation, curarisation, ventilation protectrice, décubitus ventral, monoxyde d'azote) sont parfois mises en défaut. Dans ces situations, malgré l'optimisation des réglages du ventilateur de réanimation, il devient impossible de maintenir une oxygénation satisfaisante.
L'hypoxémie provoque ou aggrave des dysfonctions d'organes, menaçant la survie à court terme. En parallèle, ces lésions pulmonaires sont également responsables d'une diminution des capacités d'élimination du CO2, ce qui engendre une hypercapnie, elle-même à l'origine d'une acidose respiratoire rapidement intolérable. Chez ces patients, il est alors logique de discuter le recours à une assistance respiratoire extra-corporelle.
ECMO : comment ça marche ?
Cet acronyme signifie Extra-Corporeal Membrane Oxygenation. Quoiqu'un peu barbare, ce sigle résume cependant bien son fonctionnement. Le principe de l'ECMO est en effet assez simple et consiste en l'utilisation d'un circuit sanguin extra-corporel comportant sur son trajet une membrane permettant des échanges gazeux (parfois appelée « poumon artificiel ») [cf. Figure 2]:
- une première canule veineuse de gros calibre est insérée dans le secteur veineux et son extrémité est positionnée dans la veine cave, à proximité du cœur droit ;
- cette canule veineuse est connectée à une pompe qui aspire le sang veineux dans le circuit extra-corporel, et dirige le flux sanguin vers une membrane spécialement conçue pour permettre d'oxygéner et de décarboxyler le sang du patient ;
- une seconde canule est insérée dans un autre vaisseau, qui permet d'assurer un retour de ce sang oxygéné et décarboxylé vers le patient ;
- lorsque l'ECMO est employée comme assistance respiratoire exclusive, la canule de retour est insérée dans une grosse veine et son extrémité placée dans la veine cave ; on parle alors d'ECMO veino-veineuse ou ECMO-VV ;
- en revanche, s'il existe une défaillance cardiaque associée ou isolée, la canule de retour est insérée dans une grosse artère et son extrémité est positionnée dans l'aorte ; on parle alors d'ECMO veino-artérielle ou ECMO-VA.
Figure 2 - Dispositif d'ECMO
Les échanges gazeux réalisés à l'aide de ce circuit extra-corporel viennent s'ajouter à ceux qui sont encore possibles au niveau des poumons endommagés par la pneumopathie, mais qui sont toujours ventilés mécaniquement pendant la phase d'ECMO. Cependant, grâce à l'ECMO, il est alors possible de limiter l'agression pulmonaire provoquée par la ventilation mécanique, en diminuant les volumes courants insufflés et les pressions générées dans les voies respiratoires (concept de « ventilation ultra-protectrice »), facilitant ainsi la cicatrisation et la récupération des fonctions pulmonaires. Cette phase d'assistance respiratoire extra-corporelle dure habituellement plusieurs jours, et parfois plusieurs semaines.
L'assistance respiratoire procurée par l'ECMO est remarquablement efficace en ce qui concerne sa capacité à oxygéner et décarboxyler le sang des patients atteints de formes sévères de SDRA.
La méthode est assez ancienne (début des années 1970), mais les améliorations apportées aux différents composants du circuit (canules, pompe, membrane) et une meilleure maîtrise des conditions techniques d'implantation l'ont remise au premier plan des techniques de sauvetage au cours des 15 dernières années (1).
Lors de l'épidémie de grippe H1N1 en 2009, beaucoup de patients ont développé un SDRA sévère nécessitant la mise sous ventilation mécanique, et environ 10 % à 30 % d'entre eux ont nécessité une assistance respiratoire extra-corporelle par ECMO-VV (2, 3).
Lorsque les indications sont bien sélectionnées, cette technique permet d'améliorer la survie, comme cela a été montré dans des essais cliniques récents (4).
Bien sûr, la mortalité hospitalière de cette population est particulièrement élevée (environ 20 à 30 %), mais de nombreuses survies peuvent être obtenues grâce à cette technique de dernier recours. Il était donc logique que l'emploi de l'ECMO soit rapidement inclus dans la panoplie thérapeutique des réanimateurs confrontés à la COVID-19, et ce fût le cas très tôt puisque les premières utilisations en Chine ont été rapportées au tout début de l'année 2020 (5).
Quels ont été les résultats obtenus avec l'ECMO au cours de l'épidémie de COVID-19 ?
Dès le début de la pandémie, la place potentielle de l'ECMO-VV a été évoquée pour la prise en charge des formes les plus sévères de SDRA (6). Son usage s'est ensuite répandu, comme en témoignent les données des registres internationaux qui colligent les cas de patients traités par ces assistances extra-corporelles.
Comme attendu, l'ECMO-VV a été la technique d'assistance la plus utilisée chez les patients atteints de COVID-19, même si l'ECMO-VA a parfois été employée (7).
Des critères de sélection ont été proposés et largement diffusés, afin que les indications retenues soient standardisées. Ils reposent essentiellement sur la constatation d'une hypoxémie sévère (rapport PaO2/FiO2 < 150) et/ou d'une acidose respiratoire (pH < 7,25 avec PaCO2 > 60 mmHg), réfractaire aux moyens conventionnels de ventilation mécanique, et après élimination des contre-indications à la mise en place de l'ECMO.
En France, les premières données publiées par l'équipe de Sorbonne Université (8) sur une série de 83 patients traités par ECMO au cours de la première vague de COVID-19 ont montré des résultats très encourageants. La mortalité à 60 jours (31 %) s'est révélée comparable à celle observée au cours des autres situations de SDRA ayant nécessité une ECMO. Parmi les 12 patients qui ont été assistés par ECMO pour des durées supérieures à 50 jours, 6 d'entre eux étaient vivants et sevrés de l'ECMO à 90 jours.
Le registre COVID-ICU (intensive care unit) a colligé les données concernant 4 244 adultes admis dans l'un des 138 services de réanimation participants pour un COVID-19 au cours de cette première vague. Dans cette large série, 80 % des patients ont été intubés et 11% ont eu besoin d'une ECMO pendant leur prise en charge (9).
Quelles sont les principales limites de l'utilisation de l'ECMO ?
La première limite à son utilisation réside dans sa disponibilité. Même si son usage s'est un peu démocratisé au cours de la dernière décennie, il s'agit d'une technique très spécialisée, difficile à mettre en œuvre dans tous les hôpitaux. Il a d'ailleurs été montré que son efficacité sur l'amélioration de la survie dépend en partie de l'importance de son utilisation dans un service donné, confirmant ainsi qu'il fallait réserver son usage à des centres spécialisés ayant un usage régulier de l'ECMO. Ce n'est donc pas encore une technique qui peut être employée en routine dans tous les services de réanimation et, lorsqu'elle est envisagée, il peut être nécessaire de transférer le patient vers un centre si son état clinique le permet.
De nombreux pays se sont pourvus d'unités mobiles d'assistance circulatoire (UMAC). Il s'agit d'équipes spécialisées dans la mise en place de l'ECMO, capables de se déplacer dans des délais très courts vers un établissement pour y implanter une ECMO en urgence, rendant alors possible un transport ultérieur du patient vers un centre spécialisé (10). Cette stratégie a été largement employée en France au cours des différentes vagues de la pandémie COVID-19, avec des résultats très encourageants (11).
La deuxième limite réside dans la sélection appropriée des indications. L'ECMO est une technique efficace, mais qui expose à des complications majeures, notamment infectieuses et hémorragiques. Ainsi, dans la série de Sorbonne Université, 42 % des patients ont présenté une hémorragie sévère pendant la phase d'assistance par ECMO et 48 % au moins un épisode de bactériémie (8). Le bénéfice attendu doit être bien évalué car un emploi large et irraisonné aboutirait immanquablement à un rapport risque-bénéfice défavorable.
En résumé, dans les formes sévères de SDRA de la COVID-19, l'ECMO constitue une technique complémentaire efficace. C'est un élément important dans la panoplie thérapeutique du réanimateur, mais qui doit être employé avec raison et mesure compte tenu des complications qui demeurent fréquentes.
©vidal.fr
Pour en savoir plus
1 - Brodie D, Slutsky AS, Combes A. Extracorporeal Life Support for Adults With Respiratory Failure and Related Indications: A Review. JAMA. 2019 Aug 13;322(6):557-568.
2 - Australia and New Zealand Extracorporeal Membrane Oxygenation (ANZ ECMO) Influenza Investigators ; Extracorporeal Membrane Oxygenation for 2009 Influenza A(H1N1) Acute Respiratory Distress Syndrome. JAMA. 2009 Nov 4;302(17):1888-95.
3 - Patroniti N, Zangrillo A, Pappalardo F, et al. The Italian ECMO network experience during the 2009 influenza A(H1N1) pandemic: preparation for severe respiratory emergency outbreaks. Intensive Care Med. 2011 Sep;37(9):1447-57.
4 - Goligher EC, Tomlinson G, Hajage D, et al. Extracorporeal Membrane Oxygenation for Severe Acute Respiratory Distress Syndrome and Posterior Probability of Mortality Benefit in a Post Hoc Bayesian Analysis of a Randomized Clinical Trial. JAMA. 2018 Dec 4;320(21):2251-2259.
5 - Wang D, Hu B, Hu C, et al. Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China. JAMA 2020 Mar 17;323(11):1061-1069.
6 - Ramanathan K, Antognini D, Combes A, et al. Planning and provision of ECMO services for severe ARDS during the COVID-19 pandemic and other outbreaks of emerging infectious diseases. Lancet Respir Med 8: 518–526, 2020.
7 - Badulak J, Antonini MV, Stead CM, et al; ELSO COVID-19 Working Group Members. Extracorporeal Membrane Oxygenation for COVID-19: Updated 2021 Guidelines from the Extracorporeal Life Support Organization. ASAIO J. 2021 May 1;67(5):485-495.
8 - Schmidt M, Hajage D, Lebreton G, et al; Groupe de Recherche Clinique en REanimation et Soins intensifs du Patient en Insuffisance Respiratoire aiguE (GRC-RESPIRE) Sorbonne Universite; Paris-Sorbonne ECMO-COVID investigators: Extracorporeal membrane oxygenation for severe acute respiratory distress syndrome associated with COVID-19: A retrospective cohort study. Lancet Respir Med 8: 1121–1131, 2020.
9 - COVID-ICU Group on behalf of the REVA Network and the COVID-ICU Investigators. Clinical characteristics and day-90 outcomes of 4244 critically ill adults with COVID-19: a prospective cohort study. Intensive Care Med. 2021 Jan;47(1):60-73.
10 - Noah MA, Peek GJ, Finney SJ, et al. Referral to an extracorporeal membrane oxygenation center and mortality among patients with severe 2009 influenza A(H1N1). JAMA. 2011 Oct 19;306(15):1659-68.
11 - Lebreton G, Schmidt M, Ponnaiah M, et al; Paris ECMO-COVID-19 investigators. Extracorporeal membrane oxygenation network organisation and clinical outcomes during the COVID-19 pandemic in Greater Paris, France: a multicentre cohort study. Lancet Respir Med. 2021 Apr 19:S2213-2600(21)00096-5.. Online ahead of print. 10.1016/S2213-2600(21)00096-5

 9 minutes
9 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.