Les signaux de sécurité identifiés chez les patients traités pour une infection par le SARS-CoV-2 sont répertoriés par les Centres régionaux de pharmacovigilance (illustration).
Résumé :
L'ANSM (Agence nationale de sécurité du médicament et des produits de santé) a publié les données actualisées sur la surveillance des effets indésirables associés aux médicaments utilisés pour traiter une infection COVID-19.
D'une manière générale, les notifications sont en baisse depuis juillet 2020, en comparaison au premier semestre 2020.
Depuis juillet 2020, les corticoïdes sont, parmi les médicaments utilisés en traitement de la COVID, ceux qui concentrent le plus de signalements d'effets indésirables (51 %). Cette tendance témoigne d'une augmentation de l'utilisation des corticoïdes en cohérence avec les recommandations thérapeutiques.
Bien qu'en baisse, on observe toujours des signalements d'effets indésirables avec des médicaments non recommandés, tels que l'hydroxychloroquine.
Ce nouveau rapport intègre également les données relatives aux bithérapies d'anticorps monoclonaux, autorisés en France dans le cadre d'autorisations temporaires d'utilisation (ATU) pour les patients à risque élevé de forme grave.
En l'absence de signal de sécurité sur la tolérance de ces traitements, l'ANSM a décidé d'élargir la population cible pouvant bénéficier de ces bithérapies. À partir du 11 juin 2021, le périmètre inclut les enfants de 12 ans et plus et de nouveaux patients à risque élevé de forme grave (maladie chronique, VIH non contrôlé).
L'ANSM (Agence nationale de sécurité du médicament et des produits de santé) a publié les données actualisées sur la surveillance des effets indésirables associés aux médicaments utilisés pour traiter une infection COVID-19.
D'une manière générale, les notifications sont en baisse depuis juillet 2020, en comparaison au premier semestre 2020.
Depuis juillet 2020, les corticoïdes sont, parmi les médicaments utilisés en traitement de la COVID, ceux qui concentrent le plus de signalements d'effets indésirables (51 %). Cette tendance témoigne d'une augmentation de l'utilisation des corticoïdes en cohérence avec les recommandations thérapeutiques.
Bien qu'en baisse, on observe toujours des signalements d'effets indésirables avec des médicaments non recommandés, tels que l'hydroxychloroquine.
Ce nouveau rapport intègre également les données relatives aux bithérapies d'anticorps monoclonaux, autorisés en France dans le cadre d'autorisations temporaires d'utilisation (ATU) pour les patients à risque élevé de forme grave.
En l'absence de signal de sécurité sur la tolérance de ces traitements, l'ANSM a décidé d'élargir la population cible pouvant bénéficier de ces bithérapies. À partir du 11 juin 2021, le périmètre inclut les enfants de 12 ans et plus et de nouveaux patients à risque élevé de forme grave (maladie chronique, VIH non contrôlé).
L'Agence nationale de sécurité du médicament et des produits de santé (ANSM) publie les données actualisées de surveillance des médicaments utilisés pour traiter des patients COVID-19.
Dans ce rapport (données arrêtées en avril 2021), les auteurs distinguent 2 périodes, tenant compte de l'évolution des recommandations de prise en charge thérapeutiques et par conséquent des différences en termes d'exposition médicamenteuse (cf. notre article du 17 novembre 2020) :
- période 1 : janvier à juin 2020,
- période 2 : de juillet 2020 à avril 2021
Des notifications d'effets indésirables en baisse
Au 26 avril 2021, 703 (38 %) cas d'effets indésirables (EI) déclarés en lien avec une infection COVID-19 sont imputables aux médicaments utilisés dans le traitement de cette maladie, sur 1 854 cas au total (périodes 1 et 2).
Les autres cas d'EI (62 %) correspondent :
- à des EI liés à d'autres médicaments administrés chez ces patients (54 %)
- à des EI liés à des médicaments suspectés d'avoir aggravé l'infection COVID-19 (8 %).
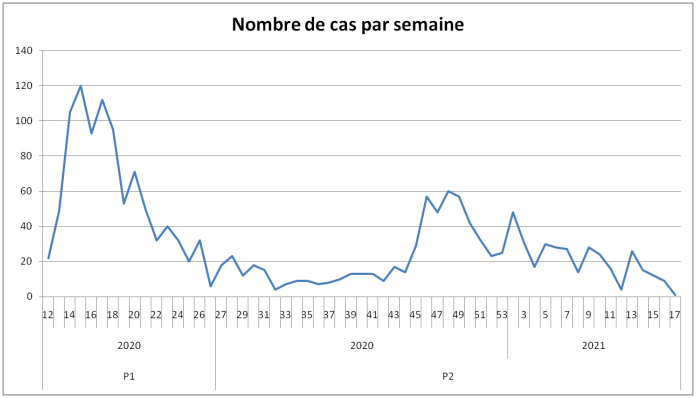
En période 2 (à partir de juillet 2020), on observe une baisse du nombre de notifications des effets indésirables des médicaments utilisés dans un contexte de COVID-19 (cf. Figure 1) :
- 742 signalements (dont 486 cas graves) en période 2,
- contre 1 109 cas pour la période 1 (dont 761 cas graves).
Figure 1 - Évolution par semaine du nombre de cas inclus en fonction de la date de notification
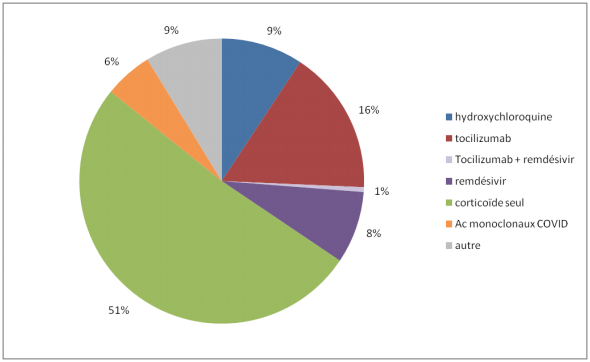
Les corticoïdes concentrent désormais la majorité des EI
Suite aux recommandations du Haut Conseil de Santé publique (HCSP) émises en octobre 2020, la dexaméthasone et d'autres corticoïdes ont été introduits dans le protocole de prise en charge de certains patients COVID-19.
Cette évolution de la stratégie thérapeutique se traduit par une augmentation du recours aux corticoïdes (dexaméthasone, méthylprednisolone, prednisone, prednisolone, bétaméthasone) en période 2 (cf. Figure 2).
En termes d'effets indésirables (EI), 111 cas sont imputables à ces médicaments (dont 41 cas graves).
Si l'on compare aux autres médicaments utilisés dans le traitement de la COVID-19, les signalements d'EI sont imputables à un corticoïde seul dans 51 % des cas, soit 1 cas sur 2.
Il s'agit d'EI attendus et connus, dont une hyperglycémie pour 70 % des signalements.
Figure 2 - Répartition des principaux médicaments utilisés dans le traitement de la COVID-19 imputés dans les effets indésirables survenus au cours de la période 2
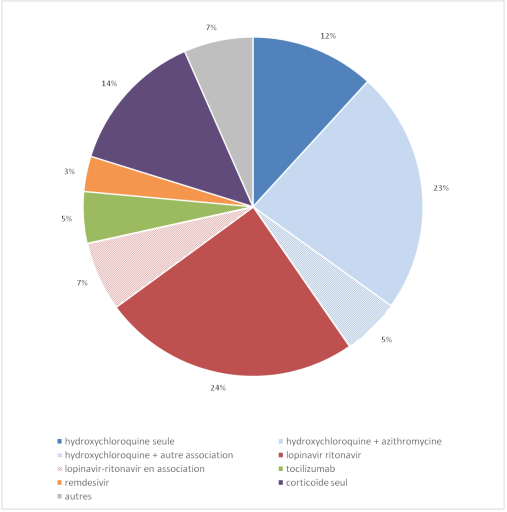
Les autres médicaments imputés par des EI : hydroxychloroquine, tocilizumab et remdésivir
Parmi les autres médicaments utilisés dans le traitement de la COVID-19 (conformément aux recommandations ou non) et auxquels sont imputables des EI, on retrouve :
- le tocilizumab, pour 17 % des cas (dont 16 % avec tocilizumab seul) : des nouveaux cas d'EI ont été rapportés et vont faire l'objet d'une surveillance rapprochée,
- l'hydroxychloroquine pour 9 % des cas,
- le remdésivir pour 8 % des cas,
- les anticorps monoclonaux COVID-19 pour 6 % des cas.
Effets indésirables signalés depuis janvier 2020 : l'hydroxychloroquine reste en tête
Si le nombre d'EI imputables à l'hydroxychloroquine seule ou associée a largement diminué en période 2 (17 cas en période 2 contre plus de 200 en période 1), ce médicament reste, pour l'ensemble de la période de surveillance (périodes 1 et 2), celui qui concentre une majorité de signalements (cf. Figure 3) :
- 40 % des cas d'EI dont 12 % avec l'hydroxychloroquine seule, 23 % avec l'hydroxychloroquine + azithromycine et 5 % avec l'hydroxychloroquine + une autre molécule en association.
Figure 3 - Répartition des médicaments utilisés dans le traitement de la COVID-19 imputés dans les effets indésirables depuis le début de l'enquête (n = 703 cas)
Anticorps monoclonaux spécifiques de la COVID-19 : un périmètre d'utilisation étendu à partir du 11 juin
Le suivi de pharmacovigilance des anticorps monoclonaux utilisés en accès précoce pour traiter les patients adultes à risque de forme grave de la COVID-19 est confié au Centre régional de pharmacovigilance de Toulouse.
Depuis février 2021, ces anticorps monoclonaux (cf. Encadré 1) sont mis à disposition en France sous le statut d'autorisation temporaire d'utilisation (ATU) de cohorte, pour traiter les patients adultes à risque élevé de développer une forme grave de la COVID-19 (cf. notre article du 16 mars 2021). Au 31 mai 2021, un peu plus de 1 000 patients ont bénéficié de ces traitements.
Encadré 1 - Bithérapies d'anticorps monoclonaux COVID-19 autorisés en France
|
Des données de pharmacovigilance rassurantes et encourageantes pour une utilisation élargie
Les données issues du premier rapport mensuel de synthèse ne montrent pas de signal de sécurité avec ces bithérapies d'anticorps monoclonaux.
Sur la période d'utilisation débutant en mars 2021, 8 cas imputables à ces anticorps monoclonaux, dont 4 graves, ont été confirmés. Ces effets indésirables étaient déjà observés dans les essais cliniques, tels que des réactions allergiques.
Cible élargie pour les bithérapies d'anticorps monoclonaux COVID-19
Prenant en compte les données de sécurité et un besoin médical non couvert dans certaines situations, l'ANSM a décidé d'élargir l'accès aux bithérapies d'anticorps monoclonaux contre la COVID-19 à partir du 11 juin 2021 aux patients dans les situations suivantes, et selon les règles de bon usage émises en mars (cf. Encadré 2) :
- enfants âgés de 12 ans et plus, à risque élevé de développer une forme grave de la COVID-19, notamment en raison d'une immunodépression sévère ;
- patients présentant une pathologie chronique, quel que soit leur âge à partir de 12 ans, tels qu'une obésité, une hypertension artérielle compliquée, un diabète ou une insuffisance rénale/respiratoire chronique ;
- patients ayant une infection par le VIH non contrôlée ou au stade SIDA.
Encadré 2 - Recommandations de bon usage des bithérapies d'anticorps monoclonaux COVID
|
Pour aller plus loin
Suivi des effets indésirables des médicaments utilisés dans la prise en charge de la COVID-19 en date du 26/04/2021 (ANSM, 9 juin 2021)
BILAN DES EFFETS INDESIRABLES TRANSMIS PAR LES CENTRES REGIONAUX DE PHARMACOVIGILANCE CHEZ LES PATIENTS PRIS EN CHARGE DANS LE CONTEXTE D'UNE INFECTION A SARS-CoV2
ET DES CAS DE MESUSAGES EN AMBULATOIRE - Rapport n°21 portant sur les données au 28 avril 2021 (ANSM, 8 juin 2021)
SUIVI DES EFFETS INDESIRABLES DES MEDICAMENTS UTILISES DANS LA PRISE EN CHARGE DU COVID-19 - Chiffres clés en date du 26 avril 2021 (ANSM, 8 juin 2021)
COVID-19 : l'accès aux bithérapies d'anticorps monoclonaux contre la Covid-19 est élargi (ANSM, 8 juin 2021)
Documents relatifs à l'utilisation des bithérapies d'anticorps monoclonaux (10 juin 2021)
PUT et de recueil d'informations - CASIRIVIMAB/IMDEVIMAB 120 mg/mL solution à diluer pour perfusion
PUT et de recueil d'informations - BAMLANIVIMAB 700 mg/20 mL (35 mg/mL) solution à diluer pour perfusion / ETESEVIMAB 700 mg/20 mL (35 mg/mL) solution à diluer pour perfusion en association
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 5 minutes
5 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.