Toutes les semaines, l'ANSM publie un rapport sur les données de pharmacovigilance relatives aux vaccins contre la COVID-19 (illustration).
Les données de pharmacovigilance sur les vaccins contre la COVID-19 recueillies par les Centres régionaux de pharmacovigilance (CRPV) entre le 12 et le 18 mars 2021 ont fait l'objet d'un rapport hebdomadaire :
- sixième rapport de surveillance pour le vaccin ASTRAZENECA COVID-19,
- dixième rapport de surveillance pour le vaccin COMIRNATY,
- septième rapport de surveillance pour le vaccin MODERNA.
Sur cette période, pour l'ensemble des 3 vaccins, 2 702 nouveaux cas d'effets indésirables (EI) ont été enregistrés, dont 24 % de cas graves (ce qui correspond à la proportion observée depuis le début de la vaccination).
Depuis le début de la vaccination, 17 104 cas d'EI ont été enregistrés et analysés sur un total de 10 394 243 injections réalisées au 27 mars 2021 (cf. Encadré 1).
Encadré 1 - Données de vaccination contre la COVID-19 en France
Données au 18 mars 2021
Données au 27 mars (source vaccintracker)
Nombre d'injections par vaccin au 27 mars 2021
|
Vaccins à ARNm : pas de signal de sécurité pour COMIRNATY et MODERNA
Pour les vaccins à ARNm COMIRNATY et VACCIN MODERNA, le profil de tolérance est largement dominé par des troubles généraux et anomalies au site d'administration, avec une prédominance féminine :
- 74 % des cas d'EI sont rapportés chez des femmes pour COMIRNATY ;
- 76 % pour le VACCIN MODERNA.
La proportion de cas graves varie légèrement par rapport à la moyenne observée depuis le début de la vaccination :
- pour COMIRNATY : 27 % de cas graves en dixième semaine de vaccination (contre 22 % depuis le début de la vaccination)
- pour VACCIN MODERNA : 19 % de cas graves en septième semaine de vaccination (contre 16 % depuis le début de la vaccination)
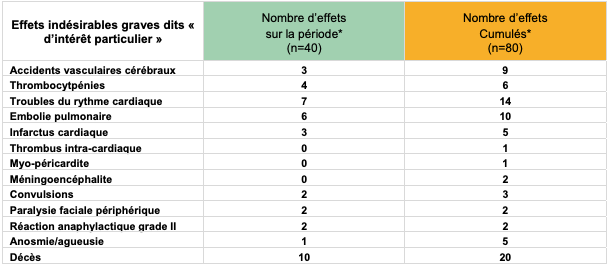
Effets cardiovasculaires et thromboemboliques graves : rien à signaler
Suite aux événements rapportés avec le vaccin à adénovirus AstraZeneca, les effets cardiovasculaires et thromboemboliques graves font l'objet d'une surveillance particulière pour l'ensemble des vaccins COVID-19.
Pour les vaccins à ARNm, les données rapportées entre le 12 et le 18 mars ne montrent pas de signal potentiel pour ces événements (cf. Tableaux I et II).
Tableau I - Zoom sur les effets indésirables graves dits "d'intérêt particulier" rapportés avec le vaccin MODERNA
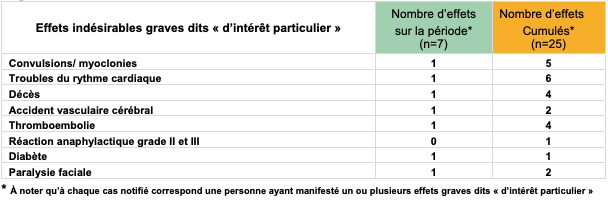
Tableau II - Zoom sur les effets indésirables graves dits "d'intérêt particulier" rapportés avec le vaccin COMIRNATY

Durant la période du 12 au 18 mars, avant sa restriction aux patients de 55 ans et plus, le vaccin ASTRAZENECA avait un profil de tolérance dominé par des troubles généraux et anomalies au site d'administration, notamment des syndromes pseudogrippaux.
Comme pour les vaccins à ARNm, les effets indésirables étaient plus fréquemment rapportés chez des femmes (76 %).
La proportion de cas graves était de 22 % (27 % depuis le début de la vaccination) et 79 % des effets indésirables étaient survenus dans la tranche d'âge 16-49 ans (entre le 12 et le 18 mars, la vaccination avec le vaccin ASTRAZENECA n'était pas encore interrompue chez les moins de 55 ans. Cette recommandation de la HAS, validée par la DGS, est applicable depuis le 19 mars 2021).
Surveillance particulière des événements cardiovasculaires et respiratoires
Parmi les événements rapportés avec le vaccin ASTRAZENECA, les effets indésirables suivants font l'objet d'une surveillance particulière :
- effets indésirables cardiaques : cas graves d'élévation de la tension artérielle survenus en dehors d'un contexte de réactogénicité (dont 4 responsables de complications neurologiques) ;
- effets indésirables respiratoires : cas de dyspnée et d'asthme associés à des cas de syndromes pseudo-grippaux.
À propos des événements thromboemboliques
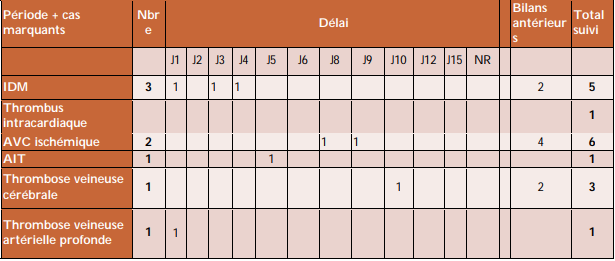
Sur l'ensemble du suivi du vaccin ASTRAZENECA, un total de 29 cas d'évènements thromboemboliques sévères a été analysé (cf. Tableau III) :
- 5 cas d'infarctus du myocarde,
- 1 cas de thrombus intracardiaque,
- 9 cas d'embolies pulmonaires,
- 7 cas de thromboses des sinus veineux cérébraux,
- 1 cas de thrombose veineuse splanchnique,
- 5 cas d'accidents vasculaires cérébraux ischémiques (AVC),
- 1 cas associant AVC/embolie pulmonaire/thrombose veineuse splanchnique dans le cadre d'une CIVD (coagulation intravasculaire disséminée).
Tableau III - Vaccin AstraZeneca : synthèse de tous les cas d'événements thromboemboliques (rapport n °6)
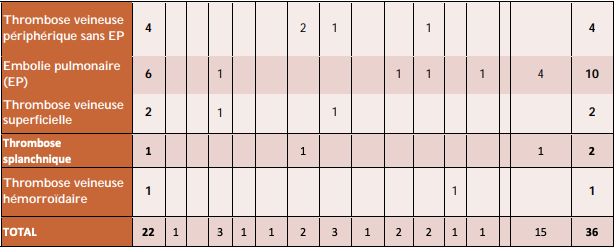
Formes atypiques de thrombose : profil des patients et circonstances de survenue
Parmi les événements thrombo-emboliques, 9 cas de thromboses des grosses veines atypiques par leur localisation (cérébrale en majorité, mais également digestive) pouvant être associés à une thrombopénie ou à des troubles de coagulation ont été déclarés, dont 2 d'issue fatale :
- délai de survenue : 8,5 jours en moyenne après la vaccination ;
- âge des patients : 7 patients de moins de 55 ans, 2 patients de plus de 55 ans ;
- profil des patients : pas d'antécédents particuliers identifiés à ce jour, en dehors d'une contraception orale dans 3 cas, associée à un déficit en protéine C/S dans un quatrième.
Un risque thrombotique confirmé avec le vaccin AstraZeneca : recommandations aux patients et professionnels de santé
"Le caractère très atypique de ces thromboses, leur tableau clinique commun et le délai de survenue homogène conduisent le comité de suivi à confirmer la survenue, très rare, de ce risque thrombotique chez les personnes vaccinées par le vaccin AstraZeneca", indique l'ANSM dans son communiqué du 26 mars 2021 synthétisant les conclusions du sixième rapport hebdomadaire de surveillance.
Dans l'attente des conclusions du groupe d'experts européens (dont les travaux portent sur le mécanisme d'action et les facteurs de risque sous-jacents susceptibles d'expliquer le risque thrombotique associé à ce vaccin), l'ANSM émet des recommandations afin d'identifier rapidement les signes et symptômes évocateurs d'un trouble thrombotique et de mettre en œuvre une prise en charge rapide :
- pour les personnes vaccinées : consulter immédiatement un médecin en présence de signes d'alerte (cf. Encadré 2) persistant quelques jours après la vaccination (au-delà de 3 jours) ;
- pour les professionnels de santé : porter une attention particulière aux signes et symptômes de thromboembolie associée ou non à une thrombopénie chez les personnes vaccinées par le vaccin AstraZeneca, afin de réaliser les examens biologiques et d'imagerie adéquats pour une prise en charge rapide de ces personnes.
Encadré 2 - Signes d'alerte évocateurs de thromboembolie
|
Pour aller plus loin
Point de situation sur la surveillance des vaccins contre la COVID-19 - Période du 12/03/2021 au 18/03/2021 (ANSM, 26 mars 2021)
Suivi des cas d'effets indésirables des vaccins COVID-19 - Données du 12 au 18 mars 2021 (ANSM, 26 mars 2021)
COVID-19 VACCINE ASTRAZENECA : risque de thrombocytopénie et de troubles de la coagulation (sur le site de l'ANSM, mars 2021)
Surveillance du vaccin ASTRAZENECA COVID-19 : rapport n °6 (ANSM, 26 mars 2021)
Surveillance du vaccin COMIRNATY : rapport n°10 (ANSM, 26 mars 2021)
Surveillance du vaccin COVID-19 MODERNA : rapport n°7 (ANSM, 26 mars 2021)
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 6 minutes
6 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.