
Un des indicateurs d'obésité est l'Indice de Masse Corporelle (IMC) lorsqu'il est supérieur à 30 (illustration).
Une nouvelle spécialité à base de liraglutide est mise à disposition : SAXENDA 6 mg/mL solution injectable SC (sous-cutanée) en stylo prérempli. Elle est indiquée, en complément d'un régime hypocalorique et d'une augmentation de l'activité physique, dans le contrôle du poids chez des patients adultes ayant un indice de masse corporelle (IMC) initial :
- > ou = 30 kg/m2 (obésité),
- ou > ou = 27 kg/m2 et < 30 kg/m2 (surpoids) en présence d'au moins un facteur de comorbidité lié au poids, tel qu'une dysglycémie (prédiabète ou diabète de type 2), une hypertension artérielle, une dyslipidémie ou un syndrome d'apnée obstructive du sommeil.
Le liraglutide déjà connu dans le diabète de type 2
Le principe actif de SAXENDA est le liraglutide, un analogue du glucagon-like peptide-1 (GLP-1) également appelé incrétinomimétique. Ce principe actif est déjà commercialisé en France via d'autres spécialités (dont une à 6 mg/mL en solution injectable en stylo prérempli, comme SAXENDA - cf. Encadré 1) indiquées dans le traitement du diabète de type 2 (cf. VIDAL Reco "Diabète de type 2 : prise en charge initiale").
Les analogues du GLP-1 augmentent la sécrétion d'insuline par les cellules bêtapancréatiques de manière glucose-dépendante, ralentissent la vidange gastrique et diminuent la sécrétion de glucagon.
Encadré 1 - Spécialités à base de liraglutide et autres spécialités contenant un analogue du GLP-1, déjà commercialisées en France dans le traitement du diabète
Spécialités à base de liraglutide
|
Études évaluant l'intérêt du liraglutide (SAXENDA) dans le contrôle du poids
Le GLP-1 est un régulateur physiologique de l'appétit et de la prise alimentaire. Le liraglutide, par l'activation spécifique du GLP-1R, agirait sur la satiété et les principaux signaux de la faim, ce qui se traduit par une perte de poids.
L'intérêt du liraglutide dans le contrôle du poids a été évalué dans 4 études principales (5 358 patients obèses ou en surpoids), randomisées versus placebo :
- Essai 1 (SCALE Obesity & Pre-Diabetes - 1839), ayant inclus des patients obèses ou en surpoids, avec dyslipidémie et/ou hypertension, et évalué la perte de poids chez l'ensemble des patients (n = 3 731 ; 56 semaines de traitement) et le délai d'apparition du diabète de type 2 chez les patients présentant un prédiabète (n = 2 254 ; 160 semaines de traitement), avec une période de suivi observationnel de 12 semaines ;
- Essai 2 (SCALE Diabetes - 1922), de 56 semaines ayant évalué la perte de poids chez des patients obèses ou en surpoids (n = 846) présentant un diabète de type 2 insuffisamment contrôlé (HbA1c comprise entre 7 et 10 %) ;
- Essai 3 (SCALE Sleep Apnoea - 3970), de 32 semaines ayant évalué l'intérêt du liraglutide sur la sévérité de l'apnée du sommeil et la perte de poids chez des patients obèse (n = 359) présentant une apnée obstructive du sommeil modérée ou sévère ;
- Essai 4 (SCALE Maintenance - 1923), de 56 semaines ayant évalué la perte de poids et la stabilisation du poids chez des patients obèses ou en surpoids (n = 422), présentant une hypertension artérielle ou une dyslipidémie après une perte de poids antérieure >= 5 % obtenue par un régime hypocalorique.
Selon les résultats de ces études, une perte de poids plus importante a été obtenue avec le liraglutide comparativement au placebo chez les patients obèses/en surpoids, dans tous les groupes étudiés. Dans toutes les populations de l'essai, davantage de patients ont obtenu une perte de poids >= 5 % et > 10 % avec le liraglutide qu'avec le placebo. Dans la partie 160 semaines de l'essai 1, la perte de poids est survenue principalement pendant la première année et a été maintenue tout au long des 160 semaines. Dans l'essai 4, davantage de patients ont réussi à stabiliser la perte de poids obtenue avant le début du traitement par le liraglutide que par le placebo (81,4 % et 48,9 % respectivement). Des données spécifiques concernant la perte de poids, les répondeurs, la chronologie et la distribution cumulative du changement du poids (%) dans les essais 1 à 4 sont présentées dans les tableaux 3 à 7 et sur les figures 1, 2 et 3 de la rubrique Pharmacodynamie de la monographie VIDAL de SAXENDA.
Globalement, SAXENDA, administré à une dose quotidienne de 3 mg, a entraîné une diminution du poids de 7,5 %, comparativement à une diminution de 2,3 % chez les patients sous placebo. La diminution de poids a été continue pendant les 40 premières semaines de traitement, après quoi la perte de poids obtenue s'est maintenue. La perte de poids était plus marquée chez les femmes que chez les hommes.
Le traitement par le liraglutide a par ailleurs significativement :
- amélioré les paramètres glycémiques dans les sous-populations ayant une glycémie normale, un prédiabète ou un diabète de type 2,
- diminué la pression artérielle systolique et le tour de taille comparativement au placebo (tableaux 3, 4 et 5),
- réduit la sévérité de l'apnée obstructive du sommeil telle qu'évaluée par la modification de l'index apnée-hypopnée (IAH = nombre d'apnées + nombre d'hypopnées/nombre d'heures de sommeil) par rapport à l'inclusion comparativement au placebo (tableau 6).
SAXENDA en pratique
À propos du système injecteur : stylo prérempli multidose
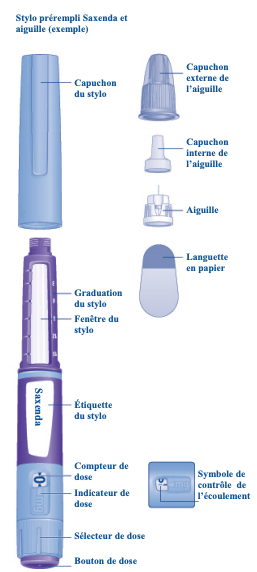
SAXENDA se présente en stylo prérempli multidose jetable (cf. Figure ci-contre et Encadré 2).
Le stylo permet d'administrer la solution de SAXENDA par voie SC, dans le ventre, la cuisse ou le haut du bras.
Le stylo est conçu pour être utilisé avec les aiguilles NovoFine ou NovoTwist à usage unique d'une longueur maximale de 8 mm et d'un diamètre minimal de 32 G.
Les aiguilles ne sont pas incluses dans le conditionnement.
Chaque stylo contient 3 mL de solution (18 mg de liraglutide, soit 6 mg/mL) et peut délivrer des doses de 0,6 mg, 1,2 mg, 1,8 mg, 2,4 mg et 3,0 mg (grâce au sélecteur de dose).
Au total, le stylo contient le volume nécessaire pour injecter :
- 30 doses de 0,6 mg
- 15 doses de 1,2 mg
- 10 doses de 1,8 mg
- 7,5 doses de 2,4 mg
- 6 doses de 3 mg
Encadré 2 - Description du stylo prérempli de SAXENDA
|
Le stylo de SAXENDA se conserve au réfrigérateur, entre 2 et 8 °C.
Après la première utilisation du stylo multidose, la durée de conservation est de 1 mois. Le stylo en cours d'utilisation peut être conservé à une température ne dépassant pas 30 °C ou au réfrigérateur (entre 2 °C et 8 °C), avec son capuchon (sans laisser l'aiguille attachée sur le stylo), afin de le protéger de la lumière.
Posologie de SAXENDA : un schéma à doses progressives
La dose initiale est de 0,6 mg 1 fois par jour.
Elle doit être augmentée jusqu'à 3 mg 1 fois par jour, par paliers de 0,6 mg espacés d'au moins 1 semaine pour améliorer la tolérance gastro-intestinale. Si l'augmentation à la dose supérieure n'est pas tolérée pendant 2 semaines consécutives, l'arrêt du traitement doit être envisagé.
La dose maximale d'entretien est de 3 mg par jour. Une dose quotidienne supérieure à 3 mg n'est pas recommandée.
SAXENDA doit être administré 1 fois par jour, quel que soit le moment de la journée, indépendamment des repas. Il est préférable d'effectuer les injections à peu près au même moment de la journée, après avoir choisi l'heure la plus adaptée.
Patients ayant un diabète de type 2 : attention aux associations médicamenteuses
SAXENDA ne doit pas être utilisé en association à un autre agoniste des récepteurs du GLP-1 (cf. Encadré 1).
Si SAXENDA est prescrit chez un patient sous insuline ou sous sécrétagogues de l'insuline (tels que les sulfamides hypoglycémiants), une réduction de la dose de ces médicaments doit être envisagée au début du traitement par SAXENDA afin de réduire le risque d'hypoglycémie.
Une autosurveillance glycémique est nécessaire pour ajuster la dose d'insuline et des sécrétagogues de l'insuline.
SAXENDA ne doit pas être utilisé comme un substitut à l'insuline. Une acidocétose diabétique a été rapportée chez des patients insulinodépendants après un arrêt brutal du traitement ou une réduction de la dose d'insuline.
Surveillance et conseils aux patients
Populations pour lesquelles SAXENDA n'est pas recommandé
L'utilisation de SAXENDA n'est pas recommandée dans les populations suivantes :
- insuffisance cardiaque congestive de classe IV New York Heart Association (NYHA),
- âge de 75 ans ou plus,
- traitement par d'autres produits utilisés pour contrôler le poids,
- obésité secondaire à des troubles endocrinologiques, à des troubles alimentaires ou à des traitements médicamenteux susceptibles d'entraîner une prise de poids,
- insuffisance rénale sévère,
- insuffisance hépatique sévère,
- maladie inflammatoire de l'intestin,
- gastroparésie diabétique (ralentissement de la vidange gastrique).
Signes et symptômes nécessitant une consultation médicale
En présence de certains signes ou symptômes, les patients doivent consulter leur médecin :
- symptômes de pancréatite aiguë : douleur abdominale persistante et sévère ;
- symptômes caractéristiques de la cholélithiase et de la cholécystite : douleur importante dans la partie supérieure du ventre, généralement du côté droit sous les côtes ;
- symptômes associés à une augmentation du rythme cardiaque : palpitations ou sensations d'emballement du cœur à l'état de repos.
Prendre en compte le risque d'hypoglycémie et de déshydratation
Les patients doivent également être informés des risques suivants, associés au traitement par SAXENDA :
- risque de déshydratation : ce risque potentiel est lié aux effets indésirables gastro-intestinaux. Les patients doivent prendre des précautions pour éviter une perte hydrique ;
- risque d'hypoglycémie : ce risque est majoré lorsque SAXENDA est utilisé en association avec une insuline ou un sulfamide hypoglycémiant. Une réduction de la dose d'insuline et/ou du sulfamide hypoglycémiant doit être envisagée.
Identité administrative
- Liste I
- Boîte de 3 stylos, CIP 3400930210574
- Non remboursable
- Non agréé aux collectivités
- Laboratoire Novo Nordisk
Pour aller plus loin
Résumé EPAR à l'intention du public - SAXENDA (EMA, 2015)
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 8 minutes
8 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.