L'infliximab est un anticorps monoclonal chimérique humain/souris qui inhibe la bioactivité du TNF-alpha et déclenche une réaction cytotoxique vis-à-vis des cellules exprimant le TNF-alpha membranaire (illustration).
La gamme REMSIMA, à base de l'inhibiteur du facteur nécrosant des tumeurs alpha (TNF-alpha) infliximab, compte désormais une forme destinée à l'administration par voie sous-cutanée (SC) :
- REMSIMA 120 mg solution injectable SC en seringue préremplie,
- REMSIMA 120 mg solution injectable SC en stylo prérempli.
Jusqu'à présent, seules des spécialités à base d'infliximab administrées par voie intraveineuse (IV) étaient disponibles (infliximab 100 mg en poudre pour solution à diluer pour perfusion IV) et distribuées uniquement dans le circuit hospitalier (médicaments réservés à l'usage hospitalier) :
- REMICADE (biomédicament de référence),
- FLIXABI (médicament biosimilaire),
- INFLECTRA (médicament biosimilaire),
- REMSIMA (médicament biosimilaire).
Avec la mise à disposition de cette première version en injection SC, l'infliximab peut désormais être délivré en pharmacie de ville.
À la différence de REMSIMA IV, REMSIMA SC n'a pas le statut de médicament biosimilaire.
REMSIMA IV/REMSIMA SC : des indications superposables chez l'adulte
REMSIMA SC a les mêmes indications chez l'adulte que REMSIMA IV, en rhumatologie, gastro-entérologie, dermatologie (cf. Encadré 1).
En revanche, REMSIMA SC ne dispose pas d'indication chez l'enfant. Pour rappel, REMSIMA IV est indiqué dans le traitement de la maladie de Crohn et de la rectocolite hémorragique chez l'enfant.
Encadré 1 - Indications thérapeutiques de REMSIMA SC
| Rhumatologie |
Polyarthrite rhumatoïde (cf. VIDAL Reco "Polyarthrite rhumatoïde")
Spondylarthrite ankylosante (cf. VIDAL Reco "Spondylarthrite ankylosante") : traitement de la spondylarthrite ankylosante active, sévère, chez les adultes qui n'ont pas répondu de manière adéquate à un traitement conventionnel. Rhumatisme psoriasique : traitement du rhumatisme psoriasique actif et évolutif chez les patients adultes quand la réponse à un précédent traitement avec les DMARDs a été inadéquate. REMSIMA doit être administré :
|
| Gastro-entérologie |
Maladie de Crohn (cf. VIDAL Reco "Maladie de Crohn") :
|
| Dermatologie |
| Psoriasis (cf. VIDAL Reco "Psoriasis en plaques de l'adulte") : traitement du psoriasis en plaques modéré à sévère des patients adultes en cas d'échec, ou de contre-indication, ou d'intolérance aux autres traitements systémiques y compris la ciclosporine, le méthotrexate ou le psoralène plus ultraviolets A (puvathérapie). |
Une évaluation médico-économique en deux étapes
REMSIMA SC est la première spécialité d'infliximab administrée par voie sous-cutanée (SC) et mise à disposition en ville.
Ce médicament a fait l'objet d'un premier avis par la Commission de la Transparence (CT) le 24 juin 2020, portant sur la seule indication dans la polyarthrite rhumatoïde.
Un nouvel avis du 7 octobre 2020 a été rendu pour les autres indications de REMSIMA SC, à savoir la maladie de Crohn, la rectocolite hémorragique, la spondylarthrite ankylosante, le rhumatisme psoriasique et le psoriasis.
Prise en charge dans la polyarthrite rhumatoïde : un périmètre restreint
Dans l'indication "polyarthrite rhumatoïde", la CT a différencié 2 situations pour lesquelles elle a attribué :
- un SMR important dans la polyarthrite rhumatoïde, en association au méthotrexate, pour la réduction des signes et symptômes, mais aussi l'amélioration des capacités fonctionnelles chez les patients adultes ayant une maladie active lorsque la réponse aux traitements de fond antirhumatismaux (DMARD), dont le méthotrexate (MTX), a été inappropriée ;
- un SMR insuffisant dans la polyarthrite rhumatoïde, en association au méthotrexate, pour la réduction des signes et symptômes, mais aussi l'amélioration des capacités fonctionnelles chez les patients adultes ayant une maladie active, sévère et évolutive, non traitée auparavant par le MTX ni les autres DMARD.
Cet avis s'appuie sur les résultats d'une étude phase III, randomisée, en double aveugle, multicentrique, ayant démontré la non-infériorité de l'infliximab 120 mg par voie SC (toutes les 2 semaines) par rapport à l'infliximab 3 mg/kg par voie IV (toutes les 8 semaines), tous deux en association au méthotrexate, chez des adultes ayant une polyarthrite rhumatoïde active. Le critère de jugement principal était la variation du score DAS28 (CRP)* à la semaine 22 par rapport à l'inclusion.
* DAS = Disease Activity Score. Il s'agit d'un score qui permet de mesurer l'activité de la maladie sur la base de 4 variables dont le marqueur de l'inflammation CRP (protéine C réactive)
En termes de tolérance, le profil de l'infliximab a été globalement similaire entre les 2 voies d'administration, les résultats suggérant toutefois une incidence plus importante de réactions systémiques ou locales liées à l'injection par voie IV, celles-ci ayant été d'intensité légère à modérée.
La CT note que REMSIMA 120 mg SC n'a été évalué, ni chez les patients naïfs de MTX, ni comparativement aux autres traitements de 2e intention de la polyarthrite rhumatoïde dans une étude clinique de comparaison directe.
Évaluation des autres indications en dermatologie, gastro-entérologie et rhumatologie
Pour les autres indications, un avis été rendu le 7 octobre 2020, selon lequel la CT a attribué à REMSIMA SC :
- un SMR modéré dans l'indication de l'AMM pour la maladie de Crohn, la rectocolite hémorragique, la spondylarthrite ankylosante et le rhumatisme psoriasique,
- un SMR modéré pour le psoriasis en plaques, uniquement chez l'adulte ayant un psoriasis en plaques chronique sévère, défini par :
- un échec (réponse insuffisante, contre-indication ou intolérance) à au moins deux traitements parmi les traitements systémiques non biologiques et la photothérapie,
- et une forme étendue et/ou un retentissement psychosocial important,
- un SMR insuffisant dans les autres situations de psoriasis en plaques.
REMSIMA SC en pratique
REMSIMA doit être initié sous le contrôle de médecins qualifiés expérimentés dans le diagnostic et le traitement des maladies pour lesquelles REMSIMA est indiqué.
Une carte de rappel patient doit être remise lors de l'initiation du traitement.
Les patients peuvent être préalablement traités avec, par exemple, un antihistaminique, de l'hydrocortisone et/ou du paracétamol, et la vitesse de perfusion peut être ralentie afin de diminuer les risques de réactions liées à la perfusion surtout s'il y a déjà eu des antécédents.
Pendant le traitement par REMSIMA, les autres traitements concomitants tels que les corticoïdes et les immunosuppresseurs devront être optimisés.
Une forme SC pour le traitement d'entretien, en relais de la forme IV
Dans l'ensemble de ses indications, le traitement par REMSIMA 120 mg SC est instauré en traitement d'entretien, en relais du traitement d'initiation avec la forme IV d'infliximab. REMSIMA SC permet d'injecter une dose de 120 mg. Les schémas posologiques précis sont décrits dans les monographies VIDAL REMSIMA 120 mg SC - rubrique Posologie et mode d'administration.
En cas de passage de la formulation IV du traitement d'entretien par infliximab à la formulation SC, REMSIMA SC peut être administré 8 semaines après la dernière administration des perfusions IV d'infliximab.
Le médecin doit assurer un suivi approprié des patients afin d'identifier une éventuelle réaction systémique à l'injection ou une réaction localisée au niveau du site d'injection, après administration de la première injection SC.
Modalités d'injection sous-cutanée
REMSIMA 120 mg solution injectable SC en seringue préremplie ou en stylo prérempli est administré uniquement par injection sous-cutanée au niveau :
- de l'avant des cuisses,
- de l'abdomen (hors périmètre autour du nombril),
- de la partie externe des bras (si l'injection est réalisée par un soignant).
Auto-injection possible par le patient
REMSIMA solution injectable SC en seringue préremplie ou stylo prérempli peut être utilisé par le patient lui-même. L'auto-injection est conditionnée par l'accord du médecin et sous réserve d'avoir formé le patient à la technique de l'injection SC.
Le patient doit également être informé de la conduite à tenir en présence de symptômes d'une réaction allergique, avant administration de la dose suivante, et de la nécessité de consulter immédiatement un médecin s'il présente les symptômes d'une réaction allergique grave.
Bon usage de REMSIMA SC : consignes de manipulation à donner au patient
La seringue préremplie et le stylo prérempli de REMSIMA 120 mg SC sont prêts à l'emploi. Ils sont à usage unique.
REMSIMA SC (stylo et seringue) se conserve au réfrigérateur (entre 2 °C et 8 °C), à l'abri de la lumière.
Le médicament peut être conservé à des températures pouvant aller jusqu'à 25 °C pendant une période de 28 jours maximum.
Avant l'injection, la seringue préremplie ou le stylo prérempli doivent être ramenés à température ambiante pendant 30 minutes, de façon naturelle.
Les principales différences entre les 2 systèmes d'injection SC sont le positionnement par rapport à la peau, et les caractéristiques techniques :
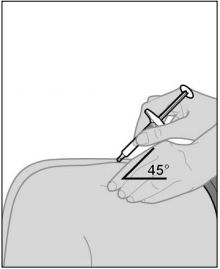 avec la seringue préremplie REMSIMA SC : la seringue préremplie doit être placée à 45° par rapport à la peau. Lorsque la seringue est vide, l'aiguille est recouverte par un dispositif de protection automatique ;
avec la seringue préremplie REMSIMA SC : la seringue préremplie doit être placée à 45° par rapport à la peau. Lorsque la seringue est vide, l'aiguille est recouverte par un dispositif de protection automatique ;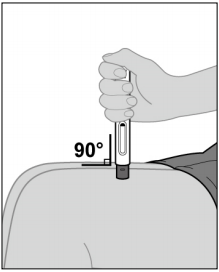 avec le stylo prérempli REMSIMA SC : le stylo comporte une fenêtre de visualisation, et un capuchon à retirer avant l'injection. Il doit être placé à 90° par rapport à la peau. L'injection se déclenche lorsque le stylo est fermement pressé contre la peau. Un premier clic sonore signale le début de l'injection. Après le second clic, il faut attendre au moins 5 secondes (compter lentement jusqu'à 5) avant de retirer le stylo. Après l'injection, la fenêtre de visualisation est fermée par la tige du piston, vert olive.
avec le stylo prérempli REMSIMA SC : le stylo comporte une fenêtre de visualisation, et un capuchon à retirer avant l'injection. Il doit être placé à 90° par rapport à la peau. L'injection se déclenche lorsque le stylo est fermement pressé contre la peau. Un premier clic sonore signale le début de l'injection. Après le second clic, il faut attendre au moins 5 secondes (compter lentement jusqu'à 5) avant de retirer le stylo. Après l'injection, la fenêtre de visualisation est fermée par la tige du piston, vert olive.
Identité administrative
- Liste I
- Médicament soumis à prescription initiale hospitalière annuelle.
- Prescription initiale et renouvellement réservés aux spécialistes en rhumatologie, en médecine interne, en hépato-gastro-entérologie ou en dermatologie.
- Boîte de 1 seringue préremplie avec dispositif de protection de l'aiguille automatique + 2 tampons d'alcool, CIP 3400930199336, prix public = 241,17 euros TTC
- Boîte de 2 seringues préremplies avec dispositif de protection de l'aiguille automatique + 2 tampons d'alcool, CIP 3400930199343, prix public = 481,16 euros TTC
- Boîte de 1 stylo prérempli + 2 tampons d'alcool, CIP 3400930199350, prix public = 241,17 euros TTC
- Boîte de 2 stylos préremplis + 2 tampons d'alcool, CIP 3400930199367, prix public = 481,16 euros TTC
- Remboursable à 65 % selon la procédure des médicaments d'exception : prescription en conformité avec la fiche d'information thérapeutique (Journal officiel du 2 février 2021 - texte 14)
- Agrément aux collectivités (Journal officiel du 2 février 2021 - texte 15)
- Inscrit sur la liste des spécialités prises en charge en sus des GHS dans le traitement de la polyarthrite rhumatoïde en association avec le méthotrexate, uniquement chez les patients adultes ayant une maladie active lorsque la réponse aux traitements de fond antirhumatismaux (DMARD), dont le méthotrexate, a été inappropriée.
- Laboratoire Celltrion Healthcare
Encadré 1 - Périmètre de prise en charge de REMSIMA SC (remboursement et agrément aux collectivités)
|
Pour aller plus loin
Avis de la Commission de la Transparence - REMSIMA SC, polyarthrite rhumatoïde (HAS, 24 juin 2020)
Avis de la Commission de la Transparence - REMSIMA SC, autres indications (HAS, 7 octobre 2020)
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 9 minutes
9 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.