
À la date du 28 janvier 2021, le comité de surveillance indique qu'il n'existe pas de signal confirmé de sécurité avec le vaccin contre la COVID-19 COMIRNATY (illustration)
Le deuxième rapport de surveillance des vaccins contre la COVID-19 publié le 28 janvier 2021 sur le site de l'ANSM (Agence nationale de sécurité du médicament et des produits de santé) porte sur :
- les événements indésirables rapportés au cours de la période du 16 au 22 janvier 2021, avec une comparaison aux données cumulées depuis le 27 décembre (début de la vaccination en France) ;
- le vaccin à ARN messager COMIRNATY (laboratoires PFIZER et BioNTech), premier vaccin mis à disposition en France et le plus utilisé à ce jour.
Depuis le début de la campagne vaccinale en France et selon les données arrêtées au 22 janvier 2021 (cf. Encadré 1) :
- 659 cas d'effets indésirables potentiellement liés au vaccin COMIRNATY ont été enregistrés dans la base nationale de pharmacovigilance, dont 81,5 % déclarés par des professionnels de santé ;
- pour 963 139 personnes vaccinées.
Encadré 1 - Organisation de la surveillance des vaccins contre la COVID-19 en France
La synthèse et le suivi des effets indésirables observés avec les vaccins contre la COVID-19 sont confiés à des centres régionaux de pharmacovigilance (CRPV) désignés rapporteurs :
Les échanges entre l'ANSM et les CRPV rapporteurs sont planifiés de la façon suivante :
En complément de ce travail, une analyse des effets/événements indésirables d'intérêt particulier (EIIP) peut être demandée par les CRPV rapporteurs, en concertation avec l'ANSM. L'analyse des EIIP est réalisée par un groupe d'experts. Chaque semaine, les résultats de l'évaluation et de l'enquête de pharmacovigilance sont présentés et discutés collégialement au sein d'un comité spécifique de l'ANSM avec les CRPV, afin d'identifier des signaux potentiels, d'envisager les mesures à prendre et d'alerter si nécessaire l'EMA (Agence européenne du médicament), les patients et les professionnels de santé. À l'issue de cette concertation, le rapport hebdomadaire de surveillance est publié sur le site de l'ANSM. |
Semaine du 16 au 21 janvier 2021 : augmentation globale du nombre de cas d'EI en relation avec l'augmentation des vaccinations
Au cours de la semaine du 16 au 22 janvier, 524 cas d'effets indésirables (EI) ont été enregistrés (sur un total de 659 cas depuis le début de la vaccination), dont :
- 21 % de cas graves (cf. Encadré 2),
- 79 % de cas non graves.
Encadré 2 - Définition du cas grave
Cas survenu chez un patient ayant présenté au moins un des critères suivants :
|
Cette progression du nombre de déclarations d'EI accompagne la forte augmentation du nombre de vaccination en France : + 574 409 personnes vaccinées du 16 au 22 janvier, contre 296 000 la semaine précédente (source Vaccin TRACKER).
Comparaison données hebdomadaires/données cumulées : une tendance identique
Concernant les EI (caractéristiques, taux de survenue, délai de survenue), les données collectées au cours de la semaine 3 (16 au 22 janvier) suivent sensiblement la même tendance que celles observées depuis le début de la campagne de vaccination (données cumulées depuis le 27 décembre 2020) :
- Ratio cas graves/cas déclarés : 1/5. En semaine 3, le taux de cas graves était de 21 %, contre 20 % en données cumulées ;
- délai de survenue : la majorité des EI (environ 78 %) survient dans les 24 heures qui suivent l'injection ;
- répartition des EI non graves attendus par organe (cf. Figure 1) : les EI non graves inattendus sont les troubles généraux et au site d'administration ;
Figure 1 - Répartition des effets indésirables non graves inattendus par organe
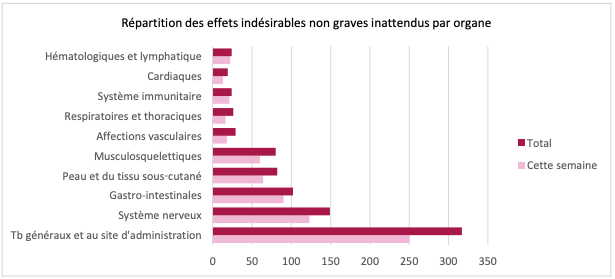
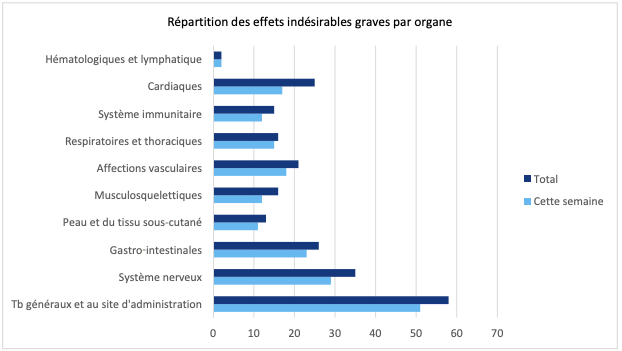
- répartition des EI graves par organe (cf. Figure 2) : les EI graves les plus signalés sont les troubles généraux et au site d'administration.
Figure 2 - Répartition des effets indésirables graves par organe
Tolérance de COMIRNATY en fonction du profil du patient
L'analyse des données de pharmacovigilance par profil patients met en évidence :
- une prédominance féminine : près de 3/4 des EI sont survenus chez des femmes ;
- une prédominance d'EI dans la population des 50-74 ans : cette classe comptabilise à elle seule un peu plus de la moitié des cas rapportés. En comparaison, les plus de 65 ans comptabilisent 1/4 des EI déclarés pour plus de 2 fois plus de personnes vaccinées (source Vaccin TRACKER).
Choc anaphylactique : 4 cas enregistrés en semaine 2
Les EI de type allergie correspondent à 17,5 % des déclarations (115 au total).
Les manifestations allergiques de grade I sont les plus fréquentes (77 % des cas non graves et 13 % des cas graves).
En semaine 3 (16 au 22 janvier), 4 cas (15,4 %) ont été considérés comme des cas d'anaphylaxie de grade 3, correspondant à un choc anaphylactique, contre 0 depuis le début de la vaccination en France :
- 1 cas d'anaphylaxie est survenu chez un patient avec antécédents allergiques (amoxicilline) 1 minute après l'injection : brûlure immédiate au point d'injection, perte de connaissance avec tension artérielle imprenable ;
- 1 cas est survenu immédiatement après l'injection : hypotension sévère, tachycardie et hypoventilation, suivi d'un œdème de la face et des lèvres ;
- 1 cas est survenu entre 30 et 60 minutes après l'injection : hypotension artérielle sévère et vomissements ;
- 1 cas est survenu entre 15 et 30 minutes après la vaccination : hypotension artérielle, bradycardie et bronchospasme.
Identification des EI d'intérêt spécifique et des EI inattendus
En semaine 3 (16 au 22 janvier), 59 événements indésirables supplémentaires, considérés comme d'intérêt particulier, ont été déclarés ; ce qui porte à 74 le nombre de cas d'événements indésirables d'intérêt spécifique (EIIS) au total depuis le début de la vaccination. Parmi ces cas, 56 ont été classés comme des EI graves (75,7 %) [cf. Tableau I].
Tableau I - Zoom sur les effets indésirables graves dits « d'intérêt particulier »
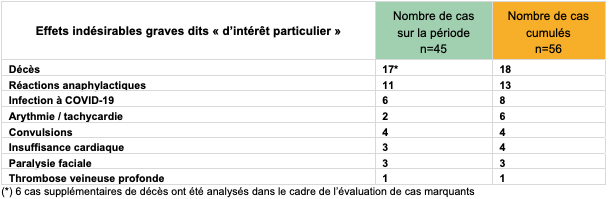
En outre, 126 cas rapportés depuis le début de la vaccination sont classés comme des EI inattendus. Parmi ces cas, 25 (19,8 %) correspondaient à des cas graves :
- 6 cas d'hypertension,
- 4 cas de zona,
- 2 cas de vestibulite et un cas de vertige positionnel paroxystique bénin,
- 2 cas de dissection aortique, dont un discuté dans le rapport précédent,
- 2 AVC hémorragiques,
- 2 AVC ischémiques (un troisième cas est compté dans les EIIS car associé à un décès),
- 1 arrêt cardiaque,
- 1 coma d'origine inconnue,
- 1 choriorétinite non infectieuse,
- 1 éruption avec atteinte hépatique,
- 1 cas d'éructation répétées toutes les 2-3 secondes ayant duré plus de 12 heures et conduit à une nuit d'hospitalisation,
- 1 cas de raideur nucale dans un contexte de réactogénicité considérée médicalement significative.
Décès rapportés chez des sujets vaccinés : pas de lien de causalité
Au total, 18 décès ont été rapportés, dont une majorité concernait des patients âgés de plus de 75 ans.
Trois décès ont été rapportés chez des personnes plus jeunes :
- deux personnes entre 50 à 60 ans atteintes de pathologies extrêmement lourdes,
- un patient âgé entre 70 et 75 ans avec antécédent de pathologie respiratoire nécessitant un appareillage.
Vaccin MODERNA : des données à étoffer
À ce jour, seuls quelques cas d'effets indésirables avec le vaccin MODERNA, tous non graves, ont été rapportés et transmis aux CRPV rapporteurs (Lille et Besançon).
Ces déclarations n'ont pas encore fait l'objet d'un rapport hebdomadaire de surveillance.
En conclusion : pas de signal de sécurité au 28 janvier 2021, mais de nouveaux éléments à surveiller
À la date du 28 janvier 2021, le comité de surveillance conclut qu'il n'existe pas de signal confirmé de sécurité avec le vaccin contre la COVID-19 COMIRNATY.
Après analyse des données, les populations ou éléments suivants devront faire l'objet d'une surveillance spécifique dans les prochaines semaines :
- patients vaccinés et ayant eu des antécédents connus d'infection à SARS-CoV-2 : dans cette population, les déclarations mettent en évidence, pour seule particularité, une plus forte proportion de réactogénicité systémique non grave (fièvre, fatigue, maux de tête, frissons, vomissements, diarrhées), comparativement aux patients sans antécédent connu d'infection à SARS-CoV-2 ;
- hypertension (10 cas) : des données complémentaires sont nécessaires pour déterminer si l'hypertension est consécutive à une réaction liée à la vaccination ou s'il s'agit d'un EI propre du vaccin ;
- atteintes vestibulaires : les cas rapportés sont peu nombreux (5) et d'évolution favorable, mais ces données sont limitées.
Pour aller plus loin
Point de situation sur la surveillance des vaccins contre la COVID-19 (ANSM, 29 janvier 2021)
Suivi des cas d'effets indésirables des vaccins COVID-19 - Données du 16 au 22 janvier 2021 / Synthèse (ANSM, mis en ligne le 29 janvier 2021)
Suivi de pharmacovigilance du vaccin Pfizer - BioNTech COMIRNATY - Données du 16 au 22 janvier 2021 / Rapport complet - 28 janvier 2021 (ANSM, 28 janvier 2021)
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 7 minutes
7 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.