Que penser des usages hors AMM proposés pour les vaccins contre la COVID-19 ? (illustration).
Depuis la commercialisation des vaccins Pfizer/BioNTech et Moderna (ainsi que celle de celui d'Oxford University/AstraZeneca au Royaume-Uni) et dans le contexte de la généralisation outre-Manche d'un variant de SARS-CoV-2 potentiellement plus transmissible, une course est lancée pour vacciner le plus grand nombre de personnes vulnérables le plus rapidement possible.
Outre les variables logistiques, cette vaccination à marche forcée se heurte à la quantité de doses vaccinales disponibles dans les semaines et les mois à venir. Pour tenter de compenser les limites de production des industriels, la tentation est grande de faire preuve de « créativité ». Par exemple, peu après la mise sur le marché du vaccin Pfizer/BioNTech, les autorités sanitaires américaines ont approuvé le fait de vacciner 6 personnes avec un flacon de 5 doses (qui se révèle effectivement en contenir une 6e une fois reconstitué, selon les recommandations du fabricant et l'avis de l'Agence européenne du médicament).
Plus récemment, les autorités sanitaires britanniques ont décidé de repousser à 12 semaines l'administration de la dose de rappel des 3 vaccins actuellement disponibles dans leur pays, avec l'objectif de primovacciner deux fois plus de personnes d'ici mars 2021. Dans le même but, aux États-Unis, un expert a suggéré à la FDA l'administration de deux demi-doses du vaccin Moderna à 4 semaines d'intervalle (plutôt que les deux doses complètes recommandées par la FDA et le fabricant).
Devant cette prolifération de propositions d'usage hors AMM pour ces nouveaux vaccins, il nous a semblé utile de faire le point sur les données qui sous-tendent (ou non) ces décisions, ainsi que sur les risques que ces usages pourraient faire courir.
Les décisions d'usage hors AMM prises dans les divers pays
À ce jour, les décisions d'usage hors AMM concernant les nouveaux vaccins contre la COVID-19 sont :
Outre les variables logistiques, cette vaccination à marche forcée se heurte à la quantité de doses vaccinales disponibles dans les semaines et les mois à venir. Pour tenter de compenser les limites de production des industriels, la tentation est grande de faire preuve de « créativité ». Par exemple, peu après la mise sur le marché du vaccin Pfizer/BioNTech, les autorités sanitaires américaines ont approuvé le fait de vacciner 6 personnes avec un flacon de 5 doses (qui se révèle effectivement en contenir une 6e une fois reconstitué, selon les recommandations du fabricant et l'avis de l'Agence européenne du médicament).
Plus récemment, les autorités sanitaires britanniques ont décidé de repousser à 12 semaines l'administration de la dose de rappel des 3 vaccins actuellement disponibles dans leur pays, avec l'objectif de primovacciner deux fois plus de personnes d'ici mars 2021. Dans le même but, aux États-Unis, un expert a suggéré à la FDA l'administration de deux demi-doses du vaccin Moderna à 4 semaines d'intervalle (plutôt que les deux doses complètes recommandées par la FDA et le fabricant).
Devant cette prolifération de propositions d'usage hors AMM pour ces nouveaux vaccins, il nous a semblé utile de faire le point sur les données qui sous-tendent (ou non) ces décisions, ainsi que sur les risques que ces usages pourraient faire courir.
Les décisions d'usage hors AMM prises dans les divers pays
À ce jour, les décisions d'usage hors AMM concernant les nouveaux vaccins contre la COVID-19 sont :
- au Royaume-Uni : administration de la 2e injection 12 semaines après la 1re, que ce soit pour le vaccin AstraZeneca (en cohérence avec l'AMM donnée dans ce pays), pour le vaccin Pfizer/BioNTech (au lieu des 3 semaines d'écart prévues par l'AMM) ou pour le vaccin Moderna autorisé en Europe depuis le 6 janvier 2021 (au lieu des 4 semaines d'écart).
- au Danemark : administration de la 2e injection 6 semaines après la 1re pour les vaccins Pfizer/BioNTech et Moderna.
- dans la province de Québec : report des 2es injections de « quelques semaines » pour les vaccins Pfizer/BioNTech et Moderna.
En Allemagne, le ministre de la Santé, Jens Spahn, a demandé un avis au Robert Koch Institute sur cette question. Suite à cet avis, l'Allemagne a annoncé qu'elle n'envisageait pas de retarder la 2e injection.
Les réactions des autorités de santé et des industriels
Les réactions des autorités de santé et des industriels
- À la suite de la décision britannique, la FDA s'est exprimée pour rappeler que les données disponibles ne justifient aucun des usages hors AMM proposés (espacement des injections, diminution des doses, injection d'une seule dose, vaccins différents pour la 1re et la 2e injection). Pour la FDA, ces questions, valides, devront faire l'objet d'études complémentaires afin de vérifier « la profondeur de la réponse immunitaire ainsi que la durée de la protection obtenue ». Le Dr Anthony Fauci, directeur du NIAID (National Institute for Allergy and Infectious Diseases), a exprimé un avis similaire.
- Le 4 janvier 2021, l'EMA (Agence européenne du médicament) s'est exprimée en accordant 42 jours (6 semaines) comme intervalle maximal entre les deux injections pour le vaccin Pfizer/BioNTech, mais en rappelant que son usage hors AMM engage la responsabilité du prescripteur. (Edit du 29 janvier 2021 : L'EMA est revenu sur sa décision et modifié l'AMM du vaccin Pfizer (COMIRNATY) pour préciser que la 2e injection doit être faite 21 jours après la 1e.)
- L'OMS (Organisation mondiale de la santé) a adopté la même position le 5 janvier, tout en « comprenant le besoin pour les États de rester flexibles dans le contexte épidémique actuel ».
- Au Royaume-Uni, la décision de retarder les rappels des vaccins Pfizer/BioNTech et Moderna a été prise à la suite de la publication d'un avis documenté du Joint Committee on Vaccination and Immunization (JCVI). Cet avis présente en détails les données qui ont amené à cette décision (voir ci-dessous). Notons, par ailleurs, que ce comité s'est opposé au « panachage » des vaccins (vaccins différents pour les 2 injections), ainsi qu'à l'usage d'une seule injection sans rappel. L'Independent SAGE (Scientific Advisory Group for Emergencies), un collectif indépendant de scientifiques conseillant les autorités britanniques, a approuvé les conclusions du JCVI, à la condition que des mesures complémentaires soient adoptées : intensification des mesures de réduction des contacts sociaux et de restriction des déplacements, transparence sur les détails de la stratégie de déploiement, évaluation rigoureuse des effets de ce choix avec, en particulier, mise en place rapide d'essais randomisés sur le sujet.
- Concernant les industriels, seuls Pfizer et BioNTech ont publiquement déclaré que leur vaccin n'a pas été évalué dans ces conditions et qu'il est trop tôt pour se prononcer sur la possibilité de modifier le calendrier vaccinal. Moderna ne s'est pas exprimé et AstraZeneca a rappelé que l'espacement des injections « jusqu'à 12 semaines » est inscrit dans la notice britannique de leur vaccin.
- Le 7 janvier 2021, l'ANSM (Agence nationale de sécurité du médicament et des produits de santé) a donné son avis sur le sujet et s'est rangée sur l'avis de l'EMA. En France, la 2e injection de vaccin Pfizer (COMIRNATY) doit être pratiquée entre 21 et 42 jours après la 1e injection.
Quelles sont les données sur lesquelles se sont appuyées les autorités britanniques pour prolonger le délai entre les deux injections ?
Les données relatives au vaccin Oxford University/AstraZeneca
Pour rappel (voir notre article sur le sujet), lors de l'essai de phase III de ce vaccin, les sujets du bras britannique ont reçu, par erreur, une demi-dose de vaccin lors de la 1re injection. Le temps que les équipes de recherche sachent quelle attitude adopter pour ces 2 741 patients (décision prise en lien avec les autorités de régulation britanniques), un délai important s'est écoulé entre les deux injections : 53,2 % d'entre eux ont reçu leur 2e injection plus de 12 semaines après la 1re (médiane de 84 jours). Pour cette raison, dans la notice britannique du vaccin AstraZeneca, le délai entre les 2 injections est « de 4 à 12 semaines ».
Dans ce bras « imprévu », le taux de protection a été significativement plus élevé que dans le groupe ayant reçu deux fois une dose complète à 4 semaines d'intervalle : de 90 % (IC95 % : 67,4-97,0 ; p = 0,01 ; 27 cas dans le groupe vacciné, 71 dans le groupe placebo) contre 62,1 % (41,0-75,7 ; p non précisé ; 3 cas versus 30).
Néanmoins, rien ne prouve que la meilleure efficacité observée dans ce bras soit due au délai plus important entre les deux injections : il se pourrait également qu'une première injection à demi-dose induise moins d'immunité contre l'adénovirus vecteur et améliore les effets de la 2e injection. C'est sur la base de cette différence de délai que les autorités britanniques ont repoussé le rappel à 12 semaines, restant ainsi dans les limites de l'AMM.
Il faut également souligner que seul le Royaume-Uni a approuvé le vaccin AstraZeneca, la FDA et l'EMA considérant que les données qui leur ont été présentées sont insuffisantes. La décision britannique est très probablement liée à l'implication des autorités sanitaires locales dans la gestion de l'essai de phase III, ainsi qu'à la situation épidémique difficile dans ce pays, voire à un certain nationalisme…
Les données relatives au vaccin Pfizer/BioNTech
Si la décision de repousser le rappel du vaccin AstraZeneca reste dans les limites de son AMM, ce n'est pas le cas du vaccin Pfizer/BioNTech dont le dossier indique un rappel 21 jours après la 1re injection.
Pour se justifier, le JCVI s'est appuyé sur l'article du New England Journal of Medicine présentant les données de l'essai de phase III de ce vaccin. Dans celui-ci, le taux de protection global juste avant la seconde injection est de 52,4 % (IC95% : 29,5-68,4, voir notre article sur le sujet). Mais, en ne prenant en compte que les données collectées à partir du 14e jour après la 1re injection (le temps que la réponse immunitaire s'installe), le taux de protection entre le 15e et le 28e jour apparaît être de 91 % (74-97). Entre le 15e et le 21e jour après la première injection, il serait de 89 % (52-97).
C'est essentiellement sur ces données d'analyse post-hoc (donc d'une fiabilité statistique discutable) que le JCVI s'est appuyé pour affirmer que la protection suivant la 1re injection était suffisamment bonne pour retarder la seconde. Il semble que le choix de 12 semaines comme intervalle n'ait, lui, d'autre justification que son alignement sur celui du vaccin AstraZeneca. Le JCVI n'aborde pas cet aspect de sa décision.
Dans son avis, le JCVI insiste sur la situation exceptionnelle que vit actuellement le Royaume-Uni (un Britannique sur 50 infecté par SARS-CoV-2 et présence croissante d'un variant à transmissibilité potentiellement accrue de 30 à 50 %).
Les données relatives au vaccin Moderna : le report du rappel
Le JCVI recommande également le report à 12 semaines de la 2e injection du vaccin Moderna. Ses conclusions reposent sur l'analyse des données issues du dossier présenté par Moderna à la FDA (voir notre article sur le sujet). Dans ce dossier, 2 075 personnes n'avaient reçu qu'une dose au moment de l'analyse intermédiaire, avec un suivi médian de 28 jours (1-108) après l'injection. Au moins 15 jours après la 1re injection, le taux de protection était de 92,1 % (68,8-99,1) alors qu'il était de 50,8 % (-53,6-86,6) pendant les 2 semaines suivant la 1re injection.
Malgré la petite taille relative de l'effectif, l'absence de randomisation de ces patients et la courte durée médiane de suivi, le JCVI estime que cette protection lui semble suffisamment bonne pour attendre 12 semaines avant la 2e injection (de nouveau, le délai de 12 semaines n'est pas justifié et semble simplement suivre celui du vaccin AstraZeneca).
Les données relatives au vaccin Moderna : la diminution de moitié des doses
Un autre usage hors AMM du vaccin Moderna a été proposé par le Dr Moncef Slaoui, membre du comité scientifique de l'Operation Warp Speed, dispositif destiné à favoriser la mise sur le marché de vaccins contre la COVID-19 aux États-Unis. Ce scientifique propose d'administrer deux fois 50 µg du vaccin, au lieu des deux fois 100 µg recommandés par la FDA.
Son raisonnement repose sur les données de l'étude de phase II NCT04405076 (dite « étude 201 » dans le dossier d'enregistrement de ce vaccin, voir notre article sur ce dossier). Cette étude randomisée contre placebo a comparé la réponse immunitaire chez des sujets âgés de 18 à 55 ans recevant soit 50 µg (N = 185), soit 100 µg (N = 189) du vaccin Moderna. Après les deux injections à 28 jours d'intervalle, l'élévation des anticorps neutralisants circulants (GMFR, Geometric Mean Fold-Rise) était :
Les données relatives au vaccin Oxford University/AstraZeneca
Pour rappel (voir notre article sur le sujet), lors de l'essai de phase III de ce vaccin, les sujets du bras britannique ont reçu, par erreur, une demi-dose de vaccin lors de la 1re injection. Le temps que les équipes de recherche sachent quelle attitude adopter pour ces 2 741 patients (décision prise en lien avec les autorités de régulation britanniques), un délai important s'est écoulé entre les deux injections : 53,2 % d'entre eux ont reçu leur 2e injection plus de 12 semaines après la 1re (médiane de 84 jours). Pour cette raison, dans la notice britannique du vaccin AstraZeneca, le délai entre les 2 injections est « de 4 à 12 semaines ».
Dans ce bras « imprévu », le taux de protection a été significativement plus élevé que dans le groupe ayant reçu deux fois une dose complète à 4 semaines d'intervalle : de 90 % (IC95 % : 67,4-97,0 ; p = 0,01 ; 27 cas dans le groupe vacciné, 71 dans le groupe placebo) contre 62,1 % (41,0-75,7 ; p non précisé ; 3 cas versus 30).
Néanmoins, rien ne prouve que la meilleure efficacité observée dans ce bras soit due au délai plus important entre les deux injections : il se pourrait également qu'une première injection à demi-dose induise moins d'immunité contre l'adénovirus vecteur et améliore les effets de la 2e injection. C'est sur la base de cette différence de délai que les autorités britanniques ont repoussé le rappel à 12 semaines, restant ainsi dans les limites de l'AMM.
Il faut également souligner que seul le Royaume-Uni a approuvé le vaccin AstraZeneca, la FDA et l'EMA considérant que les données qui leur ont été présentées sont insuffisantes. La décision britannique est très probablement liée à l'implication des autorités sanitaires locales dans la gestion de l'essai de phase III, ainsi qu'à la situation épidémique difficile dans ce pays, voire à un certain nationalisme…
Les données relatives au vaccin Pfizer/BioNTech
Si la décision de repousser le rappel du vaccin AstraZeneca reste dans les limites de son AMM, ce n'est pas le cas du vaccin Pfizer/BioNTech dont le dossier indique un rappel 21 jours après la 1re injection.
Pour se justifier, le JCVI s'est appuyé sur l'article du New England Journal of Medicine présentant les données de l'essai de phase III de ce vaccin. Dans celui-ci, le taux de protection global juste avant la seconde injection est de 52,4 % (IC95% : 29,5-68,4, voir notre article sur le sujet). Mais, en ne prenant en compte que les données collectées à partir du 14e jour après la 1re injection (le temps que la réponse immunitaire s'installe), le taux de protection entre le 15e et le 28e jour apparaît être de 91 % (74-97). Entre le 15e et le 21e jour après la première injection, il serait de 89 % (52-97).
C'est essentiellement sur ces données d'analyse post-hoc (donc d'une fiabilité statistique discutable) que le JCVI s'est appuyé pour affirmer que la protection suivant la 1re injection était suffisamment bonne pour retarder la seconde. Il semble que le choix de 12 semaines comme intervalle n'ait, lui, d'autre justification que son alignement sur celui du vaccin AstraZeneca. Le JCVI n'aborde pas cet aspect de sa décision.
Dans son avis, le JCVI insiste sur la situation exceptionnelle que vit actuellement le Royaume-Uni (un Britannique sur 50 infecté par SARS-CoV-2 et présence croissante d'un variant à transmissibilité potentiellement accrue de 30 à 50 %).
Les données relatives au vaccin Moderna : le report du rappel
Le JCVI recommande également le report à 12 semaines de la 2e injection du vaccin Moderna. Ses conclusions reposent sur l'analyse des données issues du dossier présenté par Moderna à la FDA (voir notre article sur le sujet). Dans ce dossier, 2 075 personnes n'avaient reçu qu'une dose au moment de l'analyse intermédiaire, avec un suivi médian de 28 jours (1-108) après l'injection. Au moins 15 jours après la 1re injection, le taux de protection était de 92,1 % (68,8-99,1) alors qu'il était de 50,8 % (-53,6-86,6) pendant les 2 semaines suivant la 1re injection.
Malgré la petite taille relative de l'effectif, l'absence de randomisation de ces patients et la courte durée médiane de suivi, le JCVI estime que cette protection lui semble suffisamment bonne pour attendre 12 semaines avant la 2e injection (de nouveau, le délai de 12 semaines n'est pas justifié et semble simplement suivre celui du vaccin AstraZeneca).
Les données relatives au vaccin Moderna : la diminution de moitié des doses
Un autre usage hors AMM du vaccin Moderna a été proposé par le Dr Moncef Slaoui, membre du comité scientifique de l'Operation Warp Speed, dispositif destiné à favoriser la mise sur le marché de vaccins contre la COVID-19 aux États-Unis. Ce scientifique propose d'administrer deux fois 50 µg du vaccin, au lieu des deux fois 100 µg recommandés par la FDA.
Son raisonnement repose sur les données de l'étude de phase II NCT04405076 (dite « étude 201 » dans le dossier d'enregistrement de ce vaccin, voir notre article sur ce dossier). Cette étude randomisée contre placebo a comparé la réponse immunitaire chez des sujets âgés de 18 à 55 ans recevant soit 50 µg (N = 185), soit 100 µg (N = 189) du vaccin Moderna. Après les deux injections à 28 jours d'intervalle, l'élévation des anticorps neutralisants circulants (GMFR, Geometric Mean Fold-Rise) était :
- 15 jours après la 2e injection : de 56,23 fois le taux de base (IC95 % 53,29-59,34) pour le groupe 50 µg et de 58,97 fois (56,52-61,52) pour le groupe 100 µg.
- 30 jours après la 2e injection : 53,65 fois (50,54-56,95) versus 54,79 fois (51,94-57,80).
Ainsi, il semble que la dose de 50 µg répétée deux fois ait le même effet que celle de 100 µg répétée deux fois, au moins à court terme. Néanmoins, cette étude n'aborde pas l'immunité cellulaire obtenue par le vaccin, ce qui est regrettable car, dans l'étude d'immunogénicité menée chez les macaques, une réduction de la dose injectée semble plus fortement affecter la réponse immunitaire cellulaire que la réponse humorale (en particulier au niveau des lymphocytes CD4 mémoire et des lymphocytes T follicular-helper indispensables au recrutement des lymphocytes B qui fabriquent les anticorps).
Les questions que posent ces usages hors AMM
Pour les vaccins à ARN messager (Pfizer et Moderna), nous ne disposons d'aucune donnée sur les conséquences d'une administration de la 2e injection 12 semaines après la première. Outre la question de la protection réelle entre les deux injections, se pose la question de l'effet de ce délai prolongé sur la qualité, l'étendue et la durée de l'immunité obtenue après le rappel. Du fait de la nouveauté technologique que ces vaccins représentent, il est de plus impossible d'extrapoler à partir de données disponibles pour d'autres types de vaccins.
En conclusion, si les usages hors AMM proposés aujourd'hui pour les vaccins à ARNm (délai de la 2e injection pour les deux vaccins, injection de demi-doses pour le vaccin Moderna) s'appuient sur des données collectées dans les essais cliniques, l'interprétation de ces données est fragilisée par leur analyse post-hoc (et par l'absence de randomisation pour les demi-doses Moderna). Cette fragilité est à la base des réactions réservées des agences sanitaires et des industriels.
De plus, ces usages hors AMM soulèvent de nombreuses questions en termes de risque, dont certaines pourraient avoir de graves conséquences collectives (sélection de mutants résistants, méfiance aggravée, faux sentiment de protection) ou individuelles (immunité insuffisante, voire effets indésirables à long terme d'origine immunitaire).
Depuis un an, cette pandémie a régulièrement porté des coups de boutoir aux bases de la méthode scientifique et de la médecine fondée sur les preuves : remise en question de l'importance des essais randomisés (hydroxychloroquine), AMM accordée sans prendre en compte l'ensemble des données disponibles (remdésivir), extension d'indication au-delà des données issues des essais cliniques (vaccination des plus de 75 ans) et, désormais, non respect des aspects posologiques de l'AMM et ce dès la commercialisation.
O tempora ! O mores !
©vidal.fr
Pour aller plus loin
Les décisions d'usage hors AMM des différents pays hors Royaume-Uni
Germany and Denmark consider delaying second Covid vaccine dose, The Guardian, 4 janvier 2021
Denmark to expand COVID-19 vaccination program by delaying second dose, MedicalPress, 4 janvier 2021
La deuxième dose reportée de « quelques semaines » dans la Capitale-Nationale, Radio Canada, 3 janvier 2021
L'avis de la FDA sur les modifications du calendrier vaccinal
FDA Statement on Following the Authorized Dosing Schedules for COVID-19 Vaccines, 4 janvier 2021
L'avis de l'EMA sur les modifications du calendrier vaccinal
EU says interval between Pfizer vaccine doses should be respected, Reuters, 4 janvier 2021
L'avis de l'OMS sur les modifications du calendrier vaccinal
No data to support UK delay of vaccines' second dose, says WHO. The Guardian, 5 janvier 2021
L'avis de l'ANSM sur la seconde dose du vaccin Pfizer
Avis de l'ANSM concernant la seconde dose du vaccin Comirnaty de Pfizer-BioNtech - Point d'Information, 7 janvier 2021
Les données présentées par le JCVI britannique (avec les données sur le vaccin Pfizer/BioNTech en Annexe A)
Optimising the COVID-19 vaccination programme for maximum short-term impact, Joint Committee on Vaccination and Immunisation (JCVI), 31 décembre 2020
L'avis du Independent SAGE sur les propositions du JCVI
Independent SAGE comment on proposal to reschedule second dose of SARS-CoV-2 vaccines in the UK, Independent SAGE, 3 janvier 2021
La notice britannique (RCP) du vaccin Oxford University - AstraZeneca, 29 décembre 2020
Les données de l'essai de phase III du vaccin Pfizer/BioNTech
Polack FP, Thomas SJ, Kitchin N et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med 2020; 383:2603-2615, 31 décembre 2020
Les données soumises par Pfizer/BioNTech à la FDA
Le document d'information publié par Pfizer/BioNTech sur leur vaccin, 9 décembre 2020
Les données sur le vaccin Moderna
Corbett KS, Flynn B, Foulds KE et al. Evaluation of the mRNA-1273 Vaccine against SARS-CoV-2 in Nonhuman Primates. N Engl J Med 2020; 383:1544-1555
Le document d'information publié par Moderna sur le vaccin mRNA-1273 (les données sur l'étude 201, p.32), 15 décembre 2020
Dose-Confirmation Study to Evaluate the Safety, Reactogenicity, and Immunogenicity of mRNA-1273 COVID-19 Vaccine in Adults Aged 18 Years and Older (NCT04405076), ClinicalTrials.gov
La lettre d'un médecin généraliste en réaction aux recommandations du JCVI
Upton MN. Where is the evidence that extending the dosing interval for the Pfizer mRNA vaccine from 3 weeks to 12 weeks is effective and safe? BMJ, 31 décembre 2020
Les questions que posent ces usages hors AMM
Pour les vaccins à ARN messager (Pfizer et Moderna), nous ne disposons d'aucune donnée sur les conséquences d'une administration de la 2e injection 12 semaines après la première. Outre la question de la protection réelle entre les deux injections, se pose la question de l'effet de ce délai prolongé sur la qualité, l'étendue et la durée de l'immunité obtenue après le rappel. Du fait de la nouveauté technologique que ces vaccins représentent, il est de plus impossible d'extrapoler à partir de données disponibles pour d'autres types de vaccins.
- Sur l'immunité accordée par la 1re injection, en termes de concentrations sanguines d'anticorps neutralisants après la 1re et la 2e injection, les vaccins Pfizer et Moderna semblent faiblement immunogènes après la première dose, mais fortement efficaces après la seconde. Par exemple, pour le vaccin Pfizer, la concentration moyenne des anticorps neutralisants chez les patients âgés de 18 à 55 ans passe de 14,4 à 360,9 après la 2e injection (comme illustré dans la figure 6 du document soumis par Pfizer à la FDA). Pour le vaccin Moderna, ces concentrations passent de 18,2 à 343,8 comme indiqué dans le tableau 2 d'un article comparant l'immunogénicité de différentes doses. Le rôle essentiel de la 2e injection est bien illustré dans la figure 1 d'une lettre à l'éditeur du New England Journal of Medicine portant sur la durée de l'immunité associée au vaccin Moderna, figure qui illustre également en quoi les effets de la première injection sont limités.
Figure 1 - Durée de l'immunité associée au vaccin Moderna
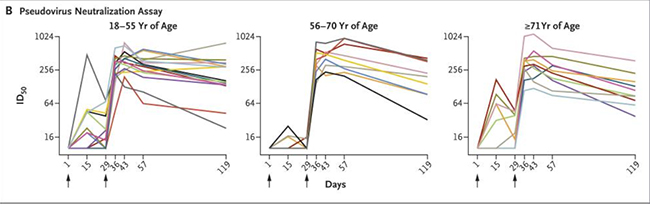

Pour le vaccin Moderna, la 2e injection (2e flèche) est essentielle pour augmenter les concentrations sanguines d'anticorps neutralisants (source : Widge AT, Rouphael NG, Jackson LA et al., 2020).
Ainsi, pour ces deux vaccins à ARNm, la 2e injection de vaccin augmente globalement les titres d'anticorps d'au moins 20 à 30 fois, peut-être plus. Ces éléments sont bien sûr à mettre en regard des données cliniques issues des essais de phase III.
- Sur l'intervalle entre les 2 injections, dans une lettre au British Medical Journal en réaction aux recommandations du JCVI, un médecin généraliste anglais évoque une étude portant sur des vaccins à ARNm visant des virus de type Influenza. Dans cette étude, un vaccin à ARNm ciblant le virus Influenza H7N9 a été administré à différents intervalles (de 21 jours à 6 mois). Chez les 5 patients ayant reçu ce vaccin à 6 mois d'intervalle, la réaction immunitaire humorale était équivalente, voire meilleure, que celle obtenue avec un rappel à 21 jours, ce qui est rassurant, mais reste peu significatif.
Enfin, il est important de noter que les données disponibles sur la protection après la 1re injection et présentées par le JCVI ou par le Dr Slaoui ont été obtenues sur des sujets jeunes (moins de 55 ans) dont la réaction immunitaire est globalement plus efficace que celle de sujets plus âgés, en particulier ceux de plus de 75 ans. Rappelons que les études effectuées avec les 3 vaccins actuels n'ont pas enrôlé suffisamment de personnes de plus de 75 ans pour prouver leur efficacité dans cette population.
Ainsi, au Royaume-Uni, les personnes actuellement vaccinées le sont par des vaccins qui n'ont pas fait leurs preuves dans leur tranche d'âge, avec un protocole vaccinal hors AMM qui s'appuie sur des analyses post-hoc portant sur des patients plus jeunes dont la réponse immunitaire est plus efficace… Certains experts recommandent de ce fait de réserver les usages hors AMM de ces vaccins aux personnes de moins de 65 ans sans vulnérabilité spécifique.
Les risques potentiels de ces usages hors AMM
Au-delà des incertitudes, en termes d'efficacité, liées à ces usages hors AMM, certains scientifiques alertent sur les risques individuels et collectifs que cette « créativité vaccinale » pourrait entraîner.
Ainsi, au Royaume-Uni, les personnes actuellement vaccinées le sont par des vaccins qui n'ont pas fait leurs preuves dans leur tranche d'âge, avec un protocole vaccinal hors AMM qui s'appuie sur des analyses post-hoc portant sur des patients plus jeunes dont la réponse immunitaire est plus efficace… Certains experts recommandent de ce fait de réserver les usages hors AMM de ces vaccins aux personnes de moins de 65 ans sans vulnérabilité spécifique.
Les risques potentiels de ces usages hors AMM
Au-delà des incertitudes, en termes d'efficacité, liées à ces usages hors AMM, certains scientifiques alertent sur les risques individuels et collectifs que cette « créativité vaccinale » pourrait entraîner.
- Au niveau individuel, retarder l'injection de rappel peut interférer avec la maturation d'affinité des anticorps neutralisants. Or cette maturation, qui a habituellement lieu entre la 2e et la 3e semaine de la réponse immunitaire, permet de sélectionner parmi les plasmocytes (lymphocytes B) ceux qui produisent les anticorps ayant la plus grande affinité avec l'antigène (et d'inhiber les plasmocytes produisant des anticorps de plus faible affinité). Une maturation altérée expose à une immunité insuffisamment spécifique et pourrait jouer un rôle dans le déclenchement d'une maladie aggravée par la vaccination (voir notre article sur le sujet), voire de maladie auto-immune. Les avis des experts divergent sur ce sujet, certains tirant le signal d'alarme (par exemple, Florian Krammer, immunologiste à la Mount Sinai School of Medicine, New York), d'autres estimant que le risque est faible sur 12 semaines (par exemple, Akiko Iwasaki, immunologiste à l'université de Yale).
- Au niveau collectif, l'existence d'une population mal immunisée contre la COVID-19, sur un fond d'immunosuppression liée à l'âge, dans un contexte épidémique explosif comme celui qui prévaut actuellement au Royaume-Uni, représente un risque important de sélection de variants de SARS-CoV-2 résistant aux anticorps neutralisants issus de la vaccination. Pour rappel, l'exposition de virus à des taux suboptimaux d'anticorps neutralisants est, in vitro, la technique de choix pour la sélection de mutants résistants à ces anticorps. Toujours au niveau collectif, certains se sont inquiétés de l'effet de ces usages hors AMM sur l'acquisition de l'immunité mucosale (dans le rhinopharynx) et sur la possible transmission de SARS-CoV-2 par les personnes ainsi vaccinées : ces usages hors AMM pourraient-ils augmenter le pourcentage de personnes vaccinées capables de transmettre le virus ?
- Sur un plan sociologique, divers experts craignent que le « bidouillage » avec le calendrier vaccinal n'accroisse le niveau de méfiance général vis-à-vis de ces vaccins. Par ailleurs, certains mettent l'accent sur le fait qu'une immunité insuffisante associée à un faux sentiment de protection puisse aboutir à une diminution de l'adoption systématique des gestes barrières et une augmentation de la prise de risque. De plus, quel effet l'espacement des injections aura-t-il sur l'observance ? Laisser croire indirectement que la 1re injection protège suffisamment risque d'augmenter le nombre de personnes négligeant leur 2e injection.
- Enfin, comme l'ont fait remarquer divers observateurs, au vu des difficultés logistiques actuellement rencontrées dans la plupart des pays, doubler le nombre de doses disponibles ne garantit pas de doubler le nombre de personnes vaccinées chaque semaine !
En conclusion, si les usages hors AMM proposés aujourd'hui pour les vaccins à ARNm (délai de la 2e injection pour les deux vaccins, injection de demi-doses pour le vaccin Moderna) s'appuient sur des données collectées dans les essais cliniques, l'interprétation de ces données est fragilisée par leur analyse post-hoc (et par l'absence de randomisation pour les demi-doses Moderna). Cette fragilité est à la base des réactions réservées des agences sanitaires et des industriels.
De plus, ces usages hors AMM soulèvent de nombreuses questions en termes de risque, dont certaines pourraient avoir de graves conséquences collectives (sélection de mutants résistants, méfiance aggravée, faux sentiment de protection) ou individuelles (immunité insuffisante, voire effets indésirables à long terme d'origine immunitaire).
Depuis un an, cette pandémie a régulièrement porté des coups de boutoir aux bases de la méthode scientifique et de la médecine fondée sur les preuves : remise en question de l'importance des essais randomisés (hydroxychloroquine), AMM accordée sans prendre en compte l'ensemble des données disponibles (remdésivir), extension d'indication au-delà des données issues des essais cliniques (vaccination des plus de 75 ans) et, désormais, non respect des aspects posologiques de l'AMM et ce dès la commercialisation.
O tempora ! O mores !
©vidal.fr
Pour aller plus loin
Les décisions d'usage hors AMM des différents pays hors Royaume-Uni
Germany and Denmark consider delaying second Covid vaccine dose, The Guardian, 4 janvier 2021
Denmark to expand COVID-19 vaccination program by delaying second dose, MedicalPress, 4 janvier 2021
La deuxième dose reportée de « quelques semaines » dans la Capitale-Nationale, Radio Canada, 3 janvier 2021
L'avis de la FDA sur les modifications du calendrier vaccinal
FDA Statement on Following the Authorized Dosing Schedules for COVID-19 Vaccines, 4 janvier 2021
L'avis de l'EMA sur les modifications du calendrier vaccinal
EU says interval between Pfizer vaccine doses should be respected, Reuters, 4 janvier 2021
L'avis de l'OMS sur les modifications du calendrier vaccinal
No data to support UK delay of vaccines' second dose, says WHO. The Guardian, 5 janvier 2021
L'avis de l'ANSM sur la seconde dose du vaccin Pfizer
Avis de l'ANSM concernant la seconde dose du vaccin Comirnaty de Pfizer-BioNtech - Point d'Information, 7 janvier 2021
Les données présentées par le JCVI britannique (avec les données sur le vaccin Pfizer/BioNTech en Annexe A)
Optimising the COVID-19 vaccination programme for maximum short-term impact, Joint Committee on Vaccination and Immunisation (JCVI), 31 décembre 2020
L'avis du Independent SAGE sur les propositions du JCVI
Independent SAGE comment on proposal to reschedule second dose of SARS-CoV-2 vaccines in the UK, Independent SAGE, 3 janvier 2021
La notice britannique (RCP) du vaccin Oxford University - AstraZeneca, 29 décembre 2020
Les données de l'essai de phase III du vaccin Pfizer/BioNTech
Polack FP, Thomas SJ, Kitchin N et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med 2020; 383:2603-2615, 31 décembre 2020
Les données soumises par Pfizer/BioNTech à la FDA
Le document d'information publié par Pfizer/BioNTech sur leur vaccin, 9 décembre 2020
Les données sur le vaccin Moderna
Corbett KS, Flynn B, Foulds KE et al. Evaluation of the mRNA-1273 Vaccine against SARS-CoV-2 in Nonhuman Primates. N Engl J Med 2020; 383:1544-1555
Le document d'information publié par Moderna sur le vaccin mRNA-1273 (les données sur l'étude 201, p.32), 15 décembre 2020
Dose-Confirmation Study to Evaluate the Safety, Reactogenicity, and Immunogenicity of mRNA-1273 COVID-19 Vaccine in Adults Aged 18 Years and Older (NCT04405076), ClinicalTrials.gov
Jackson LA, Anderson EJ, Rouphael NG et al. An mRNA Vaccine against SARS-CoV-2 — Preliminary Report. N Engl J Med. 14 juillet 2020
Widge AT, Rouphael NG, Jackson LA et al. Durability of Responses after SARS-CoV-2 mRNA-1273 Vaccination. N Engl J Med. 3 décembre 2020
La lettre d'un médecin généraliste en réaction aux recommandations du JCVI
Upton MN. Where is the evidence that extending the dosing interval for the Pfizer mRNA vaccine from 3 weeks to 12 weeks is effective and safe? BMJ, 31 décembre 2020
L'étude sur le vaccin à ARN messager contre Influenza H7N9
Feldman RA, Fuhr R, Smolenov I et al. mRNA vaccines against H10N8 and H7N9 influenza viruses of pandemic potential are immunogenic and well tolerated in healthy adults in phase 1 randomized clinical trials. Vaccine, Volume 37, Issue 25, 31 May 2019, Pages 3326-3334
Sur la maturation d'affinité des anticorps
Nos articles sur les vaccins contre la COVID-19 et les risques de maladie aggravée par ces vaccins
Vaccin Moderna : c'est la même chanson (que le vaccin Pfizer/BioNTech) avec quelques bémols. VIDAL, 17 Décembre 2020
Vaccin Oxford-AstraZeneca contre la COVID-19 : rien ne sert de partir à point si c'est pour se perdre en route…, VIDAL, 15 Décembre 2020
Vaccin Pfizer/BioNTech contre la COVID-19 : enfin des données à analyser !, VIDAL, 10 décembre 2020
Vaccins contre la COVID-19 : doit-on s'inquiéter du risque de maladie aggravée chez les personnes vaccinées ?, VIDAL, 3 novembre 2020
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 16 minutes
16 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.