RECARBRIO est notamment indiqué dans le traitement des pneumonies nosocomiales, dont les pneumonies acquises sous ventilation mécanique chez les adultes (illustration).
L'arsenal thérapeutique des antibiotiques hospitaliers bénéficie d'une nouvelle spécialité, RECARBRIO 500 mg/500 mg/250 mg poudre pour solution pour perfusion, indiquée dans le traitement :
- des pneumonies nosocomiales (PN), dont les pneumonies acquises sous ventilation mécanique (PAVM) chez les adultes ;
- d'une bactériémie associée, ou suspectée d'être associée à une PN ou une PAVM chez les adultes ;
- des infections dues à des bactéries aérobies à Gram négatif chez les adultes pour qui les options thérapeutiques sont limitées.
Il convient de tenir compte des recommandations officielles concernant l'utilisation appropriée des antibactériens.
RECARBRIO associe 3 principes actifs :
- une bêtalactamine appartenant à la classe des carbapénèmes : l'imipénem (500 mg),
- une substance qui limite le métabolisme rénal de l'imipénem : la cilastatine (500 mg),
- et un nouvel inhibiteur des bêtalactamases : le rélébactam (250 mg).
Une nouvelle alternative pour neutraliser la résistance aux carbapénèmes
En France, l'association imipénem/cilastine est commercialisée depuis plusieurs années (spécialité TIENAM et ses génériques).
L'ajout du rélébactam vise à restaurer l'activité de l'imipénem sur les bactéries à Gram négatif ayant acquis des mécanismes de résistance aux carbapénèmes, en neutralisant un certain nombre de bêtalactamases, en particulier les KPC (cf. Encadré 1).
Encadré 1 - Rélébactam, nouvel inhibiteur de bêtalactamases
| Le rélébactam est un inhibiteur non bêtalactame des bêtalactamases de classes A et C de Ambler, dont les carbapénémases Klebsiella pneumoniae carbapénémase (KPC), les bêtalactamases à spectre étendu (BLSEs) de classe A et les bêtalactamases de classe C (de type AmpC) dont les céphalosporinases produites par Pseudomonas (PDC). Le rélébactam n'inhibe pas les enzymes de classe B (métallo-bêtalactamases) ou les carbapénémases de classe D. Le rélébactam n'a pas d'activité antibactérienne. |
Un SMR important et une ASMR modérée dans une indication restreinte
RECARBRIO a fait l'objet d'une première évaluation médico-économique par la Commission de la Transparence (CT) en 2020 (avis du 23 septembre 2020), dans une indication plus restreinte que celle de l'AMM (sur demande du laboratoire - cf. Tableau I).
Tableau I - Indication de l'AMM / indication remboursable
| Indication de l'AMM concernée par la demande de remboursement | Traitement des infections dues à des bactéries aérobies à Gram négatif chez des patients adultes pour qui les options thérapeutiques sont limitées. |
| Indication remboursable (SMR important) | Utilisation en dernier recours pour le traitement des patients atteints d'infections à entérobactéries sensibles à l'association imipénem/cilastatine/rélébactam et pour lesquels le recours aux autres bêtalactamines et aux carbapénèmes (méropénem ou imipénem-cilastatine) n'est pas envisageable en cas de résistance, notamment par production de carbapénémases de type KPC. |
La CT a attribué à RECARBRIO un SMR (service médical rendu) important dans les indications de l'AMM uniquement en dernier recours pour le traitement :
- des patients atteints d'infections à entérobactéries sensibles à l'association imipénem/cilastatine/rélébactam,
- et pour lesquels le recours aux autres bêtalactamines et aux carbapénèmes (méropénem ou imipénem-cilastatine) n'est pas envisageable en cas de résistance, notamment par production de carbapénémases de type KPC.
Dans cette indication, la CT a attribué à RECARBRIO une amélioration du SMR modérée (ASMR III), tenant compte :
- "de son activité in vitro sur les entérobactéries sécrétrices de bêtalactamases à spectre étendu (EBLSE), notamment de type KPC ;
- de l'expérience acquise avec l'imipénem/cilastatine, carbapénème largement utilisé dans le traitement des infections nosocomiales sévères dues à des bactéries à Gram négatif ;
- de la démonstration de l'efficacité de l'association imipénem/cilastatine/rélébactam dans les pneumonies nosocomiales de gravité modérée à faible avec un profil de tolérance satisfaisant ;
- des données cliniques limitées (étude RESTORE-IMI 1 [NDLR : réalisée versus imipénem/cilastatine + colistine]) suggérant une efficacité importante chez des patients atteints d'infections à entérobactéries résistantes aux carbapénèmes (ERC), essentiellement par production de carbapénémases de type KPC (patients présentant une pneumonie acquise à l'hôpital, ou une PAVM, une infection intra-abdominale compliquée ou une infection urinaire compliquée) ;
- du fait que l'association imipénem/cilastatine/rélébactam est un des rares antibiotiques actuels actifs sur certaines entérobactéries productrices de carbapénèmases" (cf. Encadré 2).
Encadré 2 - Nouveaux antibiotiques disponibles en France, formulés à partir d'inhibiteurs de bêtalactamases de dernier recours pour traiter les infections à entérobactéries sécrétrices de bêtalactamase à spectre étendu (EBLSE)
|
Une alternative supplémentaire, mais de réserve
La CT considère que la place de RECARBRIO dans la stratégie thérapeutique est celle d'un traitement de dernier recours à réserver aux patients atteints d'infections à entérobactéries sensibles à l'association imipénem/cilastatine/rélébactam et pour lesquels le recours aux carbapénèmes n'est pas envisageable en cas de résistance, notamment avec un mécanisme de résistance de type KPC.
RECARBRIO (imipénem/cilastatine/rélébactam) ne doit pas être utilisé :
- comme alternative aux carbapénèmes pour le traitement des entérobactéries résistantes aux céphalosporines de troisième génération (C3G)) et pour le traitement des infections à P. aeruginosa ;
- en traitement probabiliste, mais uniquement sur documentation microbiologique.
La HAS rappelle par ailleurs que face à une infection documentée à BLSE ou fortement suspectée de l'être, l'usage de molécules autres que les carbapénèmes doit être privilégié ; l'utilisation des carbapénèmes doit être réservée à la prise en charge des infections sévères.
En pratique : administration par perfusion intraveineuse
L'utilisation de RECARBRIO nécessite l'avis d'un médecin expérimenté dans la prise en charge des maladies infectieuses.
La posologie doit être adaptée à la fonction rénale, estimée par la clairance de la créatinine (ClCr) calculée selon la formule de Cockcroft-Gault :
- si la ClCr est supérieure ou égale à 90 mL/min et < 150 mL/min : 500 mg/500 mg/250 mg toutes les 6 heures, par perfusion de 30 minutes (cf. Tableau II) ;
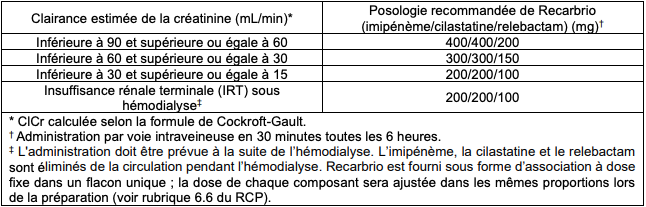
- si la ClCr est inférieure à 90 mL/min (et supérieure à 15 mL/min) : réduction de la dose (cf. Tableau III) ;
- si la ClCr est inférieure à 15 mL/min : RECARBRIO ne doit être administré que si une hémodialyse est instaurée dans les 48 heures.
Tableau II - Posologie recommandée pour l'administration intraveineuse de ROCARBRIO chez les patients présentant une ClCr > ou = 90 et < 150 mL/min1
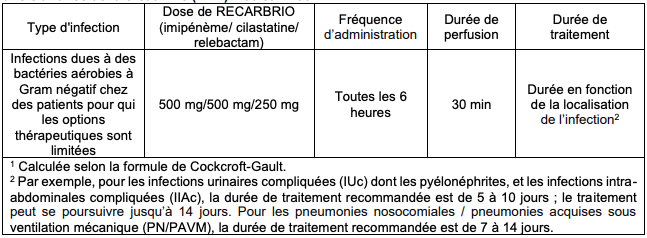
Tableau III - Posologies recommandées pour l'administration intraveineuse de ROCARBRIO chez les patients présentant une ClCr < 90 mL/min
Reconstitution et dilution avant administration
RECARBRIO se présente en poudre à reconstituer.
La reconstitution de la poudre en solution est réalisée avec une solution de chlorure de sodium 0,9 %.
La solution doit être diluée avant d'être administrée par perfusion intraveineuse.
Les solutions diluées doivent être utilisées immédiatement. L'intervalle de temps entre le début de la reconstitution et la fin de la perfusion intraveineuse ne doit pas dépasser 2 heures.
Identité administrative
- Liste I
- Prescription hospitalière
- Boîte de 25 flacons de 20 mL, CIP 3400930201268
- Agrément aux collectivités - cf. Encadré 3 (Journal officiel du 3 décembre 2020 - texte 46)
- Laboratoire MSD France
Encadré 3 - Périmètre et conditions de prise en charge de RECARBRIO
| Prise en charge uniquement en dernier recours pour le traitement des patients atteints d'infections à entérobactéries sensibles à l'association imipénem/cilastatine/rélébactam et pour lesquels le recours aux autres bêtalactamines et aux carbapénèmes (méropénem ou imipénem/cilastatine) n'est pas envisageable en cas de résistance, notamment par production de carbapénémases de type KPC. Au vu des exigences de qualité et de sécurité des soins mettant en œuvre ce médicament, la prise en charge de la spécialité pharmaceutique visée ci-dessous est subordonnée au respect de la condition relative à l'organisation des soins suivante :
|
Pour aller plus loin
Avis de la Commission de la Transparence - RECARBRIO (HAS, 23 septembre 2020)
L'étude pivot
Motsch J et al. RESTORE-IMI 1: A Multicenter, Randomized, Double-blind Trial Comparing Efficacy and Safety of Imipenem/Relebactam vs Colistin Plus Imipenem in Patients With Imipenem-non susceptible Bacterial Infections. Clin Infect Dis. 2020 May 1; 70(9): 1799–1808
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 7 minutes
7 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.