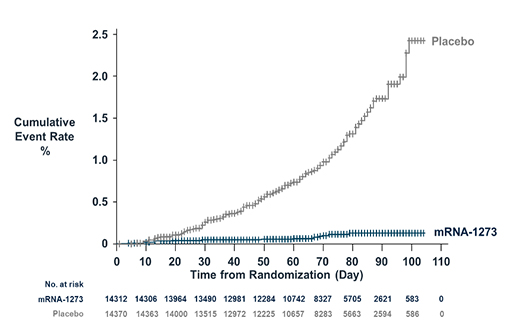
Le vaccin Moderna contre la COVID-19 protège contre les formes symptomatiques de la maladie (courbe de Kaplan-Meier, incidence cumulée, données Moderna) (illustration).
Le 15 décembre 2020, fidèles à leurs promesses, le laboratoire Moderna Therapeutics et la FDA (Food and Drug Administration) ont publié les documents d'information relatifs au vaccin contre la COVID-19 de Moderna, documents destinés à la commission d'experts indépendants qui doit examiner ce nouveau vaccin le 17 décembre 2020.
Ces documents, similaires dans leur forme à ceux publiés à l'occasion de l'examen du vaccin Pfizer/BioNTech le 10 décembre dernier (voir notre article), permettent de se faire une idée plus précise de l'efficacité et de la toxicité de ce vaccin à ARN messager.
(Edit du 18 novembre 2020) Le 17 septembre, le comité d'experts indépendants de la FDA a répondu favorablement à la question de la supériorité des bénéfices sur les risques concernant le vaccin Moderna (20 pour, 1 abstention, 0 contre).
Rappels sur le vaccin mRNA-1273
Comme le vaccin Pfizer/BioNTech (BNT162b), le vaccin Moderna (mRNA-1273) est un vaccin à ARN messager (ARNm), sans adjuvant, dont l'ARN code pour la protéine Spike (S) de SARS-CoV-2. Cet ARN est composé de nucléotides légèrement différents des nucléotides naturels (pseudo-uridines), pour ne pas déclencher une trop forte inflammation (notre système immunitaire détecte les ARN viraux, ce qui provoque la production de médiateurs immunitaires, en particulier des interférons).
Ces ARN messagers sont encapsulés dans des nanoparticules lipidiques (différentes de celles utilisées par Pfizer/BioNTech), pour mieux pénétrer dans les cellules musculaires lors de l'injection et pour stimuler la réponse immunitaire. Après lecture par les ribosomes et synthèse de la protéine S par les cellules ayant absorbé les nanoparticules, cet ARN messager est détruit et éliminé comme l'ensemble des ARN messagers produits par nos cellules.
À la différence du vaccin Pfizer/BioNTech qui doit être maintenu à -80°C (stockage), le vaccin Moderna se conserve à -20°C (stockage longue durée), puis entre 2 et 8°C pendant 1 mois (au cours des campagnes de vaccination).
Les participants de l'essai mRNA-1273-P301
L'étude de phase II/III, dont les résultats intermédiaires viennent d'être publiés, est un essai randomisé en double aveugle contre placebo (soluté physiologique) qui a été mené aux États-Unis entre avril et novembre 2020. Il est toujours en cours.
Dans cet essai, 30 418 personnes de plus de 18 ans, sans antécédents de COVID-19, ont été recrutées pour recevoir deux doses de 100 µg d'ARNm administrées à 28 jours d'intervalle. Sur ces 30 418 participants, les données de 27 817 ont été prises en compte par la FDA. Pour comparaison, l'essai relatif au vaccin BNT162b (Pfizer/BioNTech) portait sur 43 448 personnes de plus de 16 ans, avec deux doses de 30 µg d'ARNm à 21 jours d'écart (36 621 patients pris en compte dans l'analyse).
Comme pour le vaccin Pfizer/BioNTech, les promoteurs de l'essai, à la demande de la FDA, ont été vigilants quant à la diversité des profils des participants (âge, sexe, origine ethnique, risque de forme grave). L'âge médian était de 52 ans, avec 25,3 % de sujets âgés de plus de 65 ans (N = 7 026) et 4,3 % de plus de 75 ans (N = 1 712). Il est à noter que 82,1 % des participants avaient un risque professionnel aggravé vis-à-vis de la COVID-19 (professionnels de santé, travailleurs sociaux, travailleurs essentiels), dont 25,1 % de soignants. Même si les patients séropositifs pour SARS-CoV-2 étaient écartés de l'essai, 2,2 % de personnes avec des antécédents de COVID-19 ont néanmoins été inclus.
Concernant les facteurs de risque de forme sévère, 77,8 % avaient 1 facteur de risque, 22,3 % 2 facteurs de risque et 4 % plus de 2 facteurs de risque. Une stratification formelle a été faite dans le protocole pour distinguer, parmi les 18-64 ans, les personnes avec (15 %) et sans (59,8 %) facteur de risque. Les facteurs de risque pris en compte étaient le diabète, les affections respiratoires chroniques (bronchopneumopathie obstructive, mucoviscidose, asthme modéré à sévère), l'obésité morbide (IMC > 40 kg/m2), les affections cardiovasculaires « significatives » (infarctus, angor, hypertension artérielle pulmonaire), le VIH/sida et les maladies hépatiques. Ainsi, à la différence de l'essai de phase II/III de Pfizer/BioNTech, cette étude a proposé 3 sous-groupes parfaitement comparables sur le plan méthodologique (grâce à la randomisation) : 18-64 ans sans facteur de risque, 18-64 ans avec facteur de risque, 65 ans et plus.
La durée médiane de suivi des participants a été de 50 jours après la 2e injection, allant jusqu'à 9 semaines (63 jours) dans une analyse plus tardive (voir ci-dessous).
Les critères d'efficacité de l'étude mRNA-1273-P301
Le critère principal d'efficacité retenu était l'incidence des cas de COVID-19 symptomatiques confirmés par test PCR au moins 14 jours après la seconde injection (contre au moins 7 jours pour le vaccin BNT162b).
Les critères secondaires étaient :
- l'incidence de cas symptomatiques 14 jours après la 1re injection,
- l'incidence de formes graves de COVID-19 au moins 14 jours après la seconde injection,
- l'incidence de l'infection en prenant des critères cliniques élargis pour décider la mise en éuvre d'un test PCR,
- les décès dus à la COVID-19.
La décision de pratiquer un test PCR était prise lorsqu'un participant avait au moins 2 symptômes généraux (fièvre >38°C, courbatures, maux de tête, mal de gorge, anosmie, agueusie) et/ou 1 symptôme respiratoire (toux, essoufflement, pneumonie clinique ou diagnostiquée par imagerie). Les tests PCR pouvaient être nasopharyngés, nasaux, salivaires ou pratiqués sur un lavage broncho-alvéolaire.
Des données d'immunogénicité moins convaincantes que pour BNT162b
Les documents relatifs à l'étude mRNA-1273-P301 n'apportent pas de nouvelles données d'immunogénicité, ce qui est regrettable. Pour en savoir plus, le lecteur est renvoyé aux données publiées à partir des essais de phase I et de phase II.
Pour rappel, ces essais montrent une bonne immunité humorale neutralisante, en particulier après la 2e injection, avec des taux d'anticorps neutralisants « équivalents à ceux observés chez les patients convalescents ayant eu la meilleure réponse humorale post-infection (supérieure à 50 % de la réponse maximale observée). »
Néanmoins, et pour autant qu'on puisse en juger au vu des données communiquées par Moderna, cette réponse neutralisante pourrait être inférieure à celle observée avec le vaccin BNT162b. À l'inverse de Pfizer/BioNTech, Moderna n'a pas évalué la réponse neutralisante obtenue sur diverses souches de SARS-CoV-2 (souche Wuhan et souche D614G, par exemple).
Concernant la réponse immunitaire cellulaire, les données de phase II décrivent une réponse CD4/CD8 de type Th1 avec production d'interféron gamma, d'interleukine-2 et de TNF alpha. Parce que Moderna n'a pas publié de données chiffrées sur la réaction des lymphocytes après une stimulation, il est impossible de comparer la réponse cellulaire obtenue à celle constatée avec BNT162b.
Ainsi, si le vaccin Moderna semble bien être immunogène, la comparaison avec BNT162b est rarement possible en l'absence de données chiffrées. Lorsqu'elle l'est, l'avantage semble être au profit du vaccin Pfizer/BioNTech. Rappelons par ailleurs qu'une injection de vaccin mRNA-1273 contient 3,3 fois plus d'ARN messager qu'une injection de vaccin BNT162b, ce qui est une indication du bon degré de stabilité et de « transcriptabilité » de ce dernier. Espérons que des données d'immunogénicité issues de l'étude mRNA-1273-P301 seront rapidement publiées pour éclaircir ce point.
Une efficacité globale de 80,2 % après la 1re injection, atteignant 94,1 % 14 jours après la seconde
L'analyse finale de l'étude mRNA-1273-P301 a été déclenchée lorsque 151 cas de COVID-19 ont été enregistrés. Si la FDA s'est prononcée sur les données collectées jusqu'au 7 novembre (11 novembre pour la toxicité), elle a également accepté de signaler dans son rapport les données collectées jusqu'au 21 novembre (efficacité) et 25 novembre (toxicité), sans avoir pu les vérifier. Dans cet article, nous distinguerons donc les données « intérim » (11 novembre) des données « finales » (21 novembre). Pour la toxicité, nous nous appuierons sur les données au 25 novembre.
Point important, l'analyse de l'efficacité de mRNA-1273 dans divers sous-groupes (âge, comorbidités, etc.) est rendue difficile par la curieuse décision de la FDA et de Moderna de ne pas préciser l'intervalle de confiance à 95 % (IC 95%) lorsque le taux de protection atteignait 100 % (absence de cas dans le groupe vacciné). Cette décision nuit à l'appréciation de la significativité de cette protection « absolue », d'autant plus que l'effectif du sous-groupe est faible. Pourquoi la FDA n'a-t-elle pas exigé cette donnée, alors que Pfizer/BioNTech l'avait systématiquement publiée ? Mystère.
Ces précisions étant posées, dans les données « intérim », le taux de protection global observé 14 jours après la 2e injection est de 94,5 % (IC 95% : 86,5-97,8 ; 5 cas dans le groupe vacciné, 90 cas dans le groupe placebo). Dans les données « finales », ce taux est de 94,1 % (89,3-96,8 ; 11 cas versus 185).
Le nombre de cas de COVID-19 dans le groupe placebo est plus important que dans l'essai Pfizer/BioNTech (162), malgré une cohorte nettement plus petite (30 418 versus 43 448). Est-ce dû à l'importance de l'épidémie aux États-Unis tout au long de l'été et de l'automne, comparée aux 6 pays de l'étude Pfizer/BioNTech ? À l'âge médian un peu plus élevé ? À la forte proportion de participants professionnellement exposés au coronavirus (82,1 %) ?
Après la 1re injection, sur la base de 2 075 patients, le taux de protection est de 80,2 % (55,2-92,5). Ce taux de protection après la 1re injection est supérieur à celui du vaccin BNT162b (52,4 % ; 29,5-68,4), mais il convient de rappeler que l'intervalle entre les 2 injections est de 3 semaines pour ce dernier contre 4 semaines pour mRNA-1273 : au vu de la pente de la courbe d'incidence cumulée, il est possible que ces taux de protection aient été plus proches si Pfizer/BioNTech avait attendu 4 semaines après la 1re injection. Comme pour BNT162b, les courbes d'incidence cumulée commencent à être distinctes à partir du 14e jour après la 1re injection (voir illustration).
Une efficacité contre les formes sévères suggérée, mais mal étayée
L'évaluation de l'efficacité du vaccin mRNA-1273 contre les formes graves de COVID-19 est rendue délicate par le faible nombre de formes sévères observées dans les données « intérim » : 0 dans le groupe vacciné et 11 dans le groupe placebo, au moins 14 jours après la seconde injection. Dans les données « finales », le nombre de formes graves dans le groupe placebo est de 30 (et toujours de 0 dans le groupe vacciné). De nouveau, en l'absence d'IC 95%, ce taux de protection contre les formes sévères de 100 % est difficile à apprécier. Dans leur rapport, les experts de la FDA considèrent les données « finales » comme confirmant un effet sur les formes sévères, mais, à nos yeux, la prudence reste de mise au vu du faible nombre de formes graves signalées.
Parmi les 30 formes sévères, 9 ont justifié une hospitalisation. L'une est rapportée dans le groupe vacciné, mais avec une PCR négative au moment de l'hospitalisation alors qu'elle aurait été positive 3 jours auparavant (communication orale non confirmée par écrit, le cas n'a pas été pris en compte dans l'analyse).
Des analyses en sous-groupes malgré l'absence de design adéquat
À l'exception des 3 sous-groupes randomisés selon l'âge et la présence de facteurs de risque, l'étude mRNA-1273-P301 n'a pas été conçue pour une analyse par sous-groupes. Cette dernière a néanmoins été menée en post hoc, la taille des effectifs permettant une certaine tolérance. Cette analyse par sous-groupes montre, globalement, qu'un bon niveau de protection est assuré quel que soit le sous-groupe considéré (sexe, ethnicité, comorbidités) avec, bien sûr, une impossibilité à se prononcer lorsque ces sous-groupes sont de faible effectif (par exemple pour les personnes de plus de 75 ans ou pour certaines comorbidités).
L'analyse des données d'efficacité selon l'âge
Le taux de protection semble varier avec l'âge. Dans les données « intérim », les moins de 65 ans ont eu un taux de protection de 93,4 % (5 cas dans le groupe vacciné contre 75 dans le groupe placebo ; IC 95% : 83,7-97,3) et celles de plus de 64 ans un taux de 100 % (0 cas versus 15 cas ; pas d'IC 95 %). Mais, dans les données « finales », les moins de 65 ans ont eu un taux de protection de 95,6 % (90,6-97,9) et celles de plus de 64 ans un taux de 86,4 % (61,4-95,5). La protection semble donc un peu plus faible chez les personnes les plus âgées, mais reste bonne.
De plus, comme indiqué précédemment, la question de la protection des plus de 75 ans demeure, un point délicat alors que plusieurs gouvernements ont décidé de donner la priorité aux Ehpad pour la mise à disposition de ce vaccin. La protection assurée était de 100 % (sans IC 95% ; 0 cas versus 3 ; N = 1 299), mais aucune conclusion définitive ne peut être tirée de ces chiffres.
L'analyse des données d'efficacité selon la présence de facteurs de risque
Chez les 18-64 ans, les données « intérim » ont été analysées selon la présence ou non de facteurs de risque de formes sévères (rappelons que cette comparaison était inscrite dans le protocole et la randomisation, comme celle avec les 65 ans et plus) :
- chez les 18-64 ans sans facteur de risque, le taux de protection est de 93,0 % (80,8-97,5 ; 5 cas versus 75) ;
- chez les 18-64 ans avec au moins un facteur de risque, le taux de protection est de 94,6 % (59,4-99,3 ; 1 cas versus 18).
Concernant les comorbidités, les résultats ne sont interprétables que pour l'obésité, où le vaccin semble efficace :
- IMC > 30 kg/m2 : taux de protection 95,8 % (82,6-99 ; 2 cas versus 46) ;
- IMC > 40 kg/m2 : taux de protection 91,2 % (32-98,9 ; 1 cas versus 11).
Pour les autres comorbidités, des taux de protection de 100 % sont signalés, mais avec des effectifs insuffisants, sauf pour les maladies hépatiques (aucun cas dans les 2 groupes).
La curieuse affirmation de Moderna sur les formes asymptomatiques de COVID-19
Dans un addendum à son dossier, Moderna affirme apporter des éléments suggérant une efficacité de leur vaccin contre les formes asymptomatiques de COVID-19.
En effet, Moderna a effectué des tests PCR sur les participants avant chaque injection afin de dépister d'éventuelles COVID-19 asymptomatiques avant et entre les deux vaccinations. Cette mesure a permis d'identifier 52 cas de positivation de la PCR entre les injections en l'absence de symptômes : 14 dans le groupe vacciné et 38 dans le groupe placebo. Sans plus d'analyse statistique et sans information sur la possible apparition de symptômes immédiatement après la 2e injection (donc de formes présymptomatiques), Moderna affirme que « certaines formes asymptomatiques commencent à être prévenues après la 1re injection. » Mais ces observations, qui se veulent rassurantes, soulèvent a contrario le spectre inquiétant de la transmissibilité de SARS-CoV-2 par des personnes vaccinées, mais asymptomatiques : en effet, dans cette étude, 14 personnes vaccinées (une seule injection effectuée 4 semaines auparavant avec un taux de protection estimé à 80,2 %) ont été testées positives par PCR...
Les questions relatives à l'efficacité qui demeurent en suspens
Si les résultats rendus publics par Moderna et la FDA sont rassurants sur l'efficacité globale du vaccin mRNA-1273 au cours des 2 mois suivant la 2e injection, de nombreuses questions sur cette efficacité demeurent sans réponse, outre celle soulevée à propos des formes graves :
- la persistance de la protection obtenue dans le temps ;
- l'efficacité parmi les populations vulnérables aux formes graves (en particulier les insuffisants rénaux et les personnes immunodéprimées) ;
- l'efficacité chez les personnes ayant des antécédents de COVID-19 (sous-groupe trop petit pour conclure) ;
- l'efficacité chez les enfants et les moins de 18 ans ;
- l'efficacité contre les formes asymptomatiques de la COVID-19 (malgré les suggestions de Moderna) ;
- l'efficacité sur la mortalité ;
- l'efficacité contre les effets à long terme des infections acquises malgré le vaccin ;
- l'efficacité sur la transmission du virus en cas de contamination d'une personne malgré le vaccin ;
- le futur de cette efficacité si la pandémie venait à évoluer (mutations de SARS-CoV-2 par exemple).
Des effets indésirables post-injection plus sévères chez les moins de 65 ans
Comme pour le vaccin Pfizer/BioNTech, les données de toxicité présentées par Moderna et la FDA sont rassurantes. Elles ont été collectées jusqu'à 9 semaines après la 1re injection.
Les effets indésirables post-injection ont été évalués chez tous les participants qui devaient remplir un journal électronique pendant 7 jours après chaque injection (ce qui peut avoir artificiellement augmenté la fréquence des effets rapportés, les sujets étant rendus particulièrement attentifs par le dispositif de journal à remplir).
Ces effets indésirables semblent être plus fréquents chez les personnes de moins de 65 ans, ainsi qu'après la 2e injection. Les effets le plus couramment observés sont une douleur au point d'injection, une fatigue, des maux de tête et des courbatures.
Pendant la semaine suivant les injections :
Comme pour le vaccin Pfizer/BioNTech, les données de toxicité présentées par Moderna et la FDA sont rassurantes. Elles ont été collectées jusqu'à 9 semaines après la 1re injection.
Les effets indésirables post-injection ont été évalués chez tous les participants qui devaient remplir un journal électronique pendant 7 jours après chaque injection (ce qui peut avoir artificiellement augmenté la fréquence des effets rapportés, les sujets étant rendus particulièrement attentifs par le dispositif de journal à remplir).
Ces effets indésirables semblent être plus fréquents chez les personnes de moins de 65 ans, ainsi qu'après la 2e injection. Les effets le plus couramment observés sont une douleur au point d'injection, une fatigue, des maux de tête et des courbatures.
Pendant la semaine suivant les injections :
- la fatigue a été rapportée chez 68,5 % des sujets du groupe vacciné et 36,1 % du groupe placebo ;
- les maux de tête chez 63 % versus 36,5 % ;
- les courbatures chez 59,6 % versus 20,1 % ;
- les douleurs articulaires chez 44,8 % versus 17,2 % ;
- les frissons chez 43,4 % versus 9,5 % ;
- la fièvre chez 14,8 % versus 0,6 %.
Mais, attention, les pourcentages présentés ci-dessus correspondent au nombre de personnes ayant signalé cet effet indésirable rapporté au « nombre de personnes ayant répondu au moins 1 oui ou non pour cet effet après cette injection », ce qui exclut les personnes n'ayant pas répondu - parce qu'elles n'ont pas ressenti cet effet ? - et gonfle artificiellement les proportions, ce qui est perceptible d'après les pourcentages observés dans le groupe placebo.
Chez les (rares) personnes n'ayant pas eu à remplir de journal des effets indésirables, des effets secondaires après injection (identiques à ceux signalés ci-dessus) ont été spontanément signalés par 7,4 % des personnes vaccinées et 4 % de celles ayant reçu le placebo.
Les autres données de toxicité
Parmi les autres effets indésirables, certains attirent l'attention par leur fréquence plus importante dans le groupe vacciné :
- des lymphadénopathies de courte durée après les injections (191 cas dans le groupe vacciné contre 109 dans le groupe placebo), surtout chez les moins de 65 ans (1,3 % des personnes ayant déclaré des effets indésirables versus 0,74 % chez les 65 ans et plus) ;
- des paralysies du nerf facial (paralysie de Bell, 3 dans le groupe vacciné, 1 dans le groupe placebo) qui restent, comme avec le vaccin BNT162b, à surveiller dans les mois qui viennent ;
- des réactions d'hypersensibilité (rash, urticaire, édème du visage, nausées et vomissements) : 1,8 % des personnes ayant déclaré des effets indésirables contre 1 % dans le groupe placebo ; aucun cas de réaction anaphylactique ou de réaction d'hypersensibilité sévère n'a été signalé (mais les personnes allergiques étaient exclues de l'étude).
Aucun déséquilibre entre les deux groupes n'a été rapporté concernant les cas d'appendicite, contrairement au vaccin BNT162b.
Les autres effets secondaires sévères constatés plus fréquemment dans le groupe vacciné ont été les infarctus du myocarde (0,03 %), les cholécystites (0,02 %) et les calculs urinaires (0,02 %). Ceux observés plus fréquemment dans le groupe placebo (hors COVID-19) ont été la pneumonie (0,05 % dans ce groupe) et l'embolie pulmonaire (0,03 %).
Treize décès (6 dans le groupe vacciné, 7 dans le groupe placebo) ont été enregistrés. Les décès du groupe vacciné étaient dus à des accidents cardiovasculaires (3 chez des personnes de plus de 70 ans), un traumatisme crânien, une insuffisance rénale aiguë chez un patient atteint de maladie de Crohn et un suicide.
Les questions relatives à la toxicité qui demeurent en suspens
Malgré des résultats rassurants en termes de toxicité, des questions demeurent relatives à la sécurité du vaccin mRNA-1273 :
- la possibilité d'effets indésirables graves rares ou décalés dans le temps ;
- la possibilité de COVID-19 aggravée par la vaccination (voir notre article sur le sujet) ;
- la toxicité chez les moins de 18 ans, les femmes enceintes et allaitantes et les personnes immunodéprimées (exclues de l'étude). Les études de tératogénicité chez le rat sont rassurantes.
Les études qui restent à faire sur mRNA-1273
Même si les résultats examinés par la FDA sont positifs et rassurants, cette dernière insiste sur la nécessité de mener des études complémentaires pour répondre aux questions en suspens citées précédemment, tant en termes d'efficacité que de toxicité.
Moderna envisage de vacciner les personnes qui se trouvent dans le groupe placebo après 6 mois de suivi post-injections, en particulier du fait de la forte proportion de soignants parmi les participants (plus de 25 %).
En conclusion, les données présentées à la FDA sur le vaccin mRNA-1273 sont à la fois positives, avec un taux de protection très élevé dans toutes les populations concernées par l'étude, et rassurantes avec un profil de toxicité après injection acceptable. Néanmoins, elles sont moins détaillées et moins satisfaisantes que les données présentées sur le vaccin Pfizer/BioNTech, en particulier concernant l'immunogénicité et l'efficacité chez les personnes ayant des comorbidités. Au risque de nous répéter, l'absence de certains intervalles de confiance et le moindre degré de détail sur les effets indésirables sont décevants.
Beaucoup de questions demeurent. Si l'efficacité de mRNA-1273 contre les formes légères à modérées de COVID-19 et, très probablement, les formes sévères, semble confirmée, il n'en est pas de même pour les formes asymptomatiques malgré les suggestions de Moderna, même si les données disponibles vont dans le bon sens. Enfin, nous n'avons aucune information sur la durée de la protection accordée par ce vaccin.
De plus, et c'est une question essentielle pour le contrôle de la pandémie, nous ne savons rien sur la transmission du virus par des personnes vaccinées et néanmoins atteintes de formes asymptomatiques. Les données des tests PCR entre les 2 injections semblent même confirmer qu'une partie des personnes vaccinées peuvent présenter des formes asymptomatiques avec PCR nasopharyngienne positive (ce qui reste à montrer après un schéma vaccinal complet de 2 injections).
En l'absence d'informations sur cette question, le respect des gestes barrières devra persister en dépit de la vaccination, tant que la pandémie ne sera pas contrôlée. Enfin, la question d'une éventuelle toxicité à long terme se pose toujours, ainsi que celle des effets indésirables graves et rares qui pourraient advenir.
Ces points irrésolus montrent la nécessité absolue de mener des études complémentaires ciblées sur ces questions et de mettre en place des mesures de vaccinovigilance efficaces, voire d'évaluation de l'efficacité de ce vaccin chez les personnes de plus de 75 ans qui vont être massivement vaccinées dans les semaines qui viennent.
Remerciements à Eric Billy, immuno-oncologiste, et Florian Zores, cardiologue, pour leurs pertinentes analyses express de ces documents.
©Vidal.fr
Pour aller plus loin
Le document d'information publié par la FDA sur le vaccin mRNA-1273, 15 décembre 2020.
Le document d'information publié par Moderna sur le vaccin mRNA-1273, 15 décembre 2020.
L'article qui présente les résultats de la phase I/II en particulier sur l'immunogénicité
Jackson LA, Anderson EJ, Rouphael NG, et al. An mRNA Vaccine against SARS-CoV-2 ã Preliminary Report. N Engl J Med. 2020 Jul 14.
L'addendum publié par Moderna, en particulier sur la prévention des formes asymptomatiques, 15 décembre 2020.
Notre article sur les risques de maladie aggravée après vaccination contre la COVID-19
Vaccins contre la COVID-19 : doit-on s'inquiéter du risque de maladie aggravée chez les personnes vaccinées ?, VIDAL Actus, 3 novembre 2020.
Sources
Pour recevoir gratuitement toute lãactualitûˋ par mail Je m'abonne !

 17 minutes
17 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.