Classification des antalgiques par paliers selon l'Organisation mondiale de la santé (illustration).
Une nouvelle spécialité opioïde de synthèse à base de méthadone (chlorhydrate de) est désormais disponible en ville et à l'hôpital : ZORYON, la première en France à disposer d'une autorisation de mise sur le marché (AMM) dans le traitement de fond des douleurs d'origine cancéreuse (cf. Encadré 1).
Encadré 1 - Indication thérapeutique de ZORYON gélule et sirop (tous dosages)
| ZORYON est indiqué chez les adultes et les adolescents à partir de 15 ans dans le traitement de fond de douleurs d'origine cancéreuse d'intensité modérée à sévère chez les patients qui ne sont pas soulagés de façon adéquate par d'autres opioïdes de palier 3, en raison d'une efficacité insuffisante et/ou d'effets indésirables excessifs (cf. VIDAL Reco "Soins palliatifs et accompagnement"). |
ZORYON est proposé sous 2 formes pharmaceutiques, en gélule et en sirop (flacon unidose), chacune dosée à 5, 10, 20 ou 40 mg de méthadone.
De la pharmacodépendance aux opiacés à l'antalgie dans les douleurs d'origine cancéreuse
En France, la seule spécialité de méthadone commercialisée jusqu'à présent, dénommée METHADONE AP-HP et également disponible en gélule et en sirop, était indiquée dans le traitement de substitution des pharmacodépendances majeures aux opiacés (cf. VIDAL Reco "Dépendance aux opiacés : traitement de substitution").
Bien que la méthadone soit citée dans diverses recommandations dans le traitement des douleurs d'origine cancéreuse (dont les recommandations françaises de l'AFSSAPS - Douleur rebelle en situation palliative avancée chez l'adulte, 2010), ZORYON est la première spécialité à base de méthadone disposant d'une AMM dans le traitement des douleurs d'origine cancéreuse.
- Deux protocoles de conversion soumis à évaluation
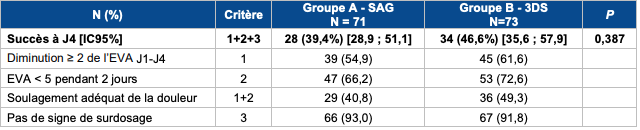
Le critère de jugement principal était le taux de réussite/échec associé au changement vers la méthadone à J4 (quatrième jour), le succès étant défini comme un soulagement adéquat de la douleur à J4 et l'absence de surdosage entre J1 et J4.
Encadré 1 - Protocole de conversion d'un traitement opioïde vers la méthadone
| Protocole à la demande : autocontrôle de la dose par le patient, sans chevauchement avec le traitement opioïde antérieur |
|
| Protocole 3DS, à dose fixe avec chevauchement avec le traitement opioïde antérieur |
|
Selon les résultats de cette étude (cf. Tableau I), il n'a pas été mis en évidence de différence statistiquement significative entre les deux protocoles de titration de la méthadone sur le critère de jugement principal, avec un pourcentage de succès d'environ 40 %.
Tableau I - Résultats sur le critère principal composite
En termes de tolérance, la Commission mentionne que les risques majeurs d'un traitement par ZORYON sont la dépression respiratoire et les troubles du système nerveux central (somnolence, confusion, etc.), comme pour tout opioïde, mais avec une probabilité de survenue élevée et maximale quelques jours après l'instauration du traitement pour la méthadone.
À ce titre, la Commission souhaite que le traitement par naloxone, antidote aux surdoses d'opioïdes indiqué dans le traitement d'urgence des surdosages aux opioïdes, caractérisés ou suspectés, soit rendu accessible aux patients traités par cet antalgique et à leur entourage.
- SMR important pour ZORYON
Elle a attribué un service médical rendu (SMR) important, sans amélioration du SMR (ASMR V), soulignant que la méthadone était une alternative antalgique supplémentaire en cas d'échec par d'autres opioïdes de palier III.
ZORYON en pratique : modalités d'instauration et de surveillance
Le traitement par ZORYON doit être instauré par une équipe hospitalière spécialisée dans la prise en charge de la douleur ou des soins palliatifs et expérimentée dans l'utilisation de la méthadone.
La posologie doit être déterminée individuellement pour chaque patient, en fonction :
- de la situation clinique (traitement antalgique antérieur, facteurs de risques d'addiction) ;
- et de l'objectif thérapeutique.
Tous les patients traités par ZORYON doivent bénéficier d'une surveillance ECG afin d'identifier un allongement de l'intervalle QT ou des torsades de pointe :
- avant l'instauration de la méthadone ;
- puis si nécessaire tout au long du traitement, notamment en cas d'augmentation de la dose ou chez des patients à risque.
Plusieurs protocoles de conversion d'un traitement opioïde vers la méthadone ont été étudiés et sont actuellement utilisés lors de l'instauration d'un traitement par méthadone dans les douleurs d'origine cancéreuses.
Le choix du protocole à utiliser lors de l'instauration du traitement est laissé à l'appréciation de l'équipe hospitalière.
Dans tous les cas, le schéma comporte une phase de titration.
- Instauration et titration : à l'hôpital
La phase de titration doit permettre de définir la posologie optimale.
Au cours de cette phase, la surveillance doit porter sur les éventuels signes de surdosage, en particulier les signes de dépression respiratoire. Ce risque est maximal durant les premiers jours après l'introduction de ZORYON.
- Poursuite du traitement à domicile
Le patient et son entourage doivent être informés des signes de surdosage et de la conduite à tenir (consultation médicale en urgence).
La poursuite du traitement doit être régulièrement réévaluée au regard des besoins antalgiques et des effets indésirables.
Comme tout traitement analgésique opioïde, le traitement par ZORYON doit être arrêté progressivement afin d'éviter les symptômes de sevrage.
- Ajustement de la posologie
En cas de mauvaise tolérance d'effets indésirables, deux options d'ajustement peuvent être suivies :
- diminution de la dose suivante ;
- modification des intervalles entre les prises (toutes les 8 heures ou toutes les 12 heures).
Identité administrative
- Stupéfiant (cf. Encadré 1)
- Prescription initiale hospitalière
- Surveillance particulière pendant le traitement
- ZORYON 5 mg
- Boîte de 7 gélules, CIP 3400930167809
- Flacon unidose (sirop), CIP 3400930167847
- ZORYON 10 mg
- Boîte de 7 gélules, CIP 3400930167854
- Flacon unidose (sirop), de CIP 3400930167908
- ZORYON 20 mg
- Boîte de 7 gélules, CIP 3400930167915
- Flacon unidose (sirop), CIP 3400930167960
- ZORYON 40 mg
- Boîte de 7 gélules, CIP 3400930167977
- Flacon unidose (sirop), CIP 3400930168028
- Remboursable à 65 % (Journal officiel du 1er avril 2020 - texte 20)
- Prix public TTC des boîtes de 7 gélules (tous dosages) = 8,72 euros
- Prix public TTC des flacons unidoses (tous dosages) = 1,51 euros
- Agrément aux collectivités (Journal officiel du 1er avril 2020 - texte 21)
- Laboratoire Bouchara Recordati
Encadré 2 - Règles de prescription et délivrance de ZORYON
|
Pour aller plus loin
Avis de la Commission de la Transparence - ZORYON (18 septembre 2019)
L'étude pivot
Poulain P. et al. Efficacy and Safety of Two Methadone Titration Methods for the Treatment of Cancer-Related Pain: The EQUIMETH2 Trial (Methadone for Cancer-Related Pain). J Pain Symptom Manage 2016 ; 52 : 626-36.
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 7 minutes
7 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.