Les effets indésirables liés à l’utilisation des médicaments chez les patients COVID-19 font l’objet d’une surveillance continue, en particulier pour l’hydroxychloroquine et le lopinavir/ritonavir (illustration).
L'Agence espagnole des médicaments et des produits de santés (AEMPS) a alerté ses voisins européens sur la survenue d'effets indésirables (EI) neuropsychiatriques chez des patients atteints du COVID-19 traités par hydroxychloroquine.
Selon les données communiquées par l'AEMPS, ces troubles se manifestent notamment par des symptômes aigus de psychose, des tentatives de suicide ou des suicides.
Les informations recueillies montrent que ces symptômes surviennent :
- en majorité au cours des premiers jours de traitement,
- à des doses élevées (dose initiale de 800 mg le premier jour, puis de 400 mg par jour),
- y compris chez des patients sans antécédents de troubles psychiatriques.
Un effet indésirable mentionné dans les RCP
Le risque de troubles neuropsychiatriques est déjà connu avec l'hydroxychloroquine et la chloroquine ; il est mentionné dans les RCP (résumés des caractéristiques du produit) des spécialités :
- PLAQUENIL : nervosité (peu fréquent), psychose (fréquence indéterminée)
- NIVAQUINE : insomnies (très fréquent), dépression (fréquent), agitation/anxiété/agressivité/troubles du sommeil/confusion/hallucination (rare), épisodes psychotiques (très rare), comportement suicidaire (fréquence indéterminée).
Une évaluation sur le risque d'EI neuropsychiatriques associés à l'hydroxychloroquine en cours
La survenue de ces troubles neuropsychiatriques pourrait être aggravée par le contexte lié à la pandémie et au confinement, ou par la maladie elle-même. Une évaluation est donc en cours au niveau européen. Ce travail doit permettre d'approfondir les connaissances sur la relation hydroxychloroquine ou chloroquine/effets neuropsychiatriques (profil des patients, relation entre effet et dose).
En France, l'utilisation d'hydroxychloroquine chez des patients COVID-19 est réalisée uniquement au sein des établissements hospitaliers, en cas de signes de gravité nécessitant l'hospitalisation et sur décision collégiale, ainsi que dans le cadre d'essais cliniques validés.
L'ANSM (Agence nationale de sécurité du médicament et des produits de santé) a pris note de cette alerte et demande aux promoteurs et investigateurs d'essais cliniques utilisant de l'hydroxychloroquine ou de la chloroquine de surveiller ce risque.
Plus généralement, les professionnels de santé sont invités à surveiller la survenue éventuelle de changements comportementaux chez les patients COVID-19 traités par chloroquine ou hydroxychloroquine.
Points sur les dernières données de pharmacovigilance françaises pour l'hydroxychloroquine et l'association lopinavir/ritonavir
Selon les dernières données de pharmacovigilance recueillies et analysées par le réseau des CRPV (centres régionaux de pharmacovigilance) français, les profils de toxicité de l'hydroxychloroquine et de l'association antivirale lopinavir/ritonavir restent confirmés (cf. Figure 1).
Figure 1 - Répartition des médicaments utilisés dans le traitement de la COVID-19 et impliqués dans les effets indésirables
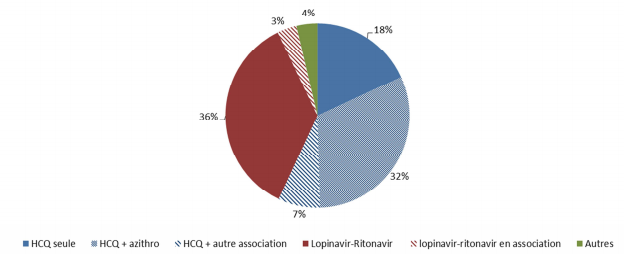
En synthèse, au 12 mai 2020, les données montrent :
- 78 % des effets indésirables déclarés en lien avec une infection COVID-19 sont graves,
- 62 % de ces cas déclarés sont imputés aux médicaments utilisés dans le traitement de la COVID-19 : hydroxychloroquine seule ou associée (plus d'un effet indésirable sur 2), lopinavir/ritonavir seule ou associée (39 % de cas), autres médicaments (4 %) ;
- ces effets indésirables sont à prédominance masculine (64 % d'hommes) ;
- pour l'hydroxychloroquine, 69 % des effets indésirables sont d'ordre cardiaque (cf. Figure 2) ;
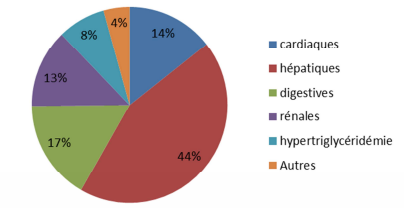
- pour l'association lopinavir/ritonavir, 44 % des effets indésirables sont d'ordre hépatique (cf. Figure 3)
Figure 2 - Répartitions des effets indésirables liés à l'hydroxychloroquine (n = 201)
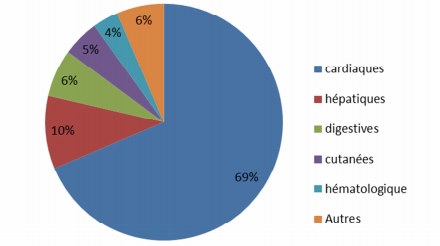
Concernant l'hydroxychloroquine, 201 cas d'effets indésirables ont été rapportés (soit 30 cas de plus que lors du précédent rapport). Il est précisé "qu'un cas peut inclure plusieurs types d'effets indésirables". Parmi eux, le nombre de cas d'atteinte cardiaque s'élève à 138 (soit 24 de plus), dont 75 en association avec l'azithromycine (soit 9 de plus), 14 avec la spiramycine (soit 2 de plus), 4 en association avec le lopinavir/ritonavir ; 7 décès ont été rapportés (soit 2 de plus).
Il est noté que le signal de cardiotoxicité continue à être confirmé, mais que le nombre de cas d'effets indésirables cardiaques des traitements hydroxychloroquine seule ou en association connaît une augmentation moins importante par rapport aux semaines précédentes.
S'agissant de l'association lopinavir/ritonavir, 139 cas d'effets indésirables ont été déclarés (soit 12 de plus que lors du précédent rapport), dont 5 en association avec l'hydroxychloroquine et 1 en association avec l'hydroxychloroquine et l'azithromycine.
Parmi ces cas, on note de nouveaux signaux de pharmacovigilance, dont :
- 61 cas d'atteinte hépatique (soit 6 de plus, dont 1 décès), dont 6 cas d'hyperbilirubinémie isolée (cf. Figure 3). Les élévations des enzymes hépatiques ont un profil majoritairement cytolytique (6 cas ayant une mention d'hyperbilirubinémie associée).
- 18 cas d'atteinte rénale, dont 12 d'insuffisance rénale aiguë (soit 1 de plus que dans le rapport précédent) et 6 cas d'oligurie sans augmentation de la créatininémie. L'évolution a été favorable à l'arrêt du traitement dans la majorité des cas, mais un cas de décès a été rapporté. Dans 3 cas, une hémodialyse a été entreprise.
Figure 3 - Répartitions des effets indésirables liés à l'association lopinavir/ritonavir (n = 139)
Pour aller plus loin
Médicaments utilisés chez les patients atteints du COVID-19 : une surveillance renforcée des effets indésirables - Point d'information (actualisé le 14/05/2020) (ANSM, 14 mai 2020)
Cloroquina/Hidroxicloroquina: precauciones y vigilancia de posibles reacciones adversas en pacientes con COVID-19 (Agence espagnole des médicaments et des produits de santé, fiche actualisée le 14 mai 2020)
Suivi des effets indésirables des médicaments utilisés dans la prise en charge du COVID-19 - Chiffres clés (ANSM, 13 mai 2020)
Bilan des effets indésirables validés dans la base nationale de pharmacovigilance concernant les patients pris en charge dans le contexte d'une infection à SARS-CoV2 et des cas de mésusage (ANSM, 14 mai 2020)
Bilan des effets indésirables validés dans la base nationale de pharmacovigilance concernant les patients pris en charge dans le contexte d'une infection à Covid19 et des cas de mésusage - CRPV Nice (ANSM, 14 mai 2020)

 5 minutes
5 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.