Le principe de la "plasma-thérapie" repose sur la présence d'anticorps actifs contre le SARS-CoV-2 dans le plasma de sujets ayant été infectés (illustration).
Face à l'urgence sanitaire et en l'absence de traitement efficace et ciblé contre l'infection par le SARS-CoV-2, l'ANSM (Agence nationale de sécurité du médicament et des produits de santé) a autorisé le recours exceptionnel aux plasmas issus de sujets COVID-19 convalescents chez des patients non inclus dans des essais cliniques, qui présentent une forme sévère de COVID-19.
Si à ce jour l'efficacité de cette thérapie par plasma n'est pas démontrée, elle fait l'objet de plusieurs essais cliniques en France. Le principe de cette thérapie repose sur la présence d'anticorps actifs contre le SARS-CoV-2 dans le plasma des sujets ayant été infectés. Cette stratégie thérapeutique pourrait présenter un intérêt chez les patients atteints de syndrome de détresse respiratoire aiguë (SDRA) et améliorer le taux de survie dans cette population.
Origine du plasma et profil des patients pris en charge
Les donneurs de plasma sont des sujets guéris du COVID-19 depuis au moins 14 jours, et en bonne santé.
Le don de plasma est volontaire et le consentement du donneur doit être recueilli.
La collecte est organisée par l'EFS (Établissement français du sang). L'EFS et le Centre de transfusion sanguine des armées sont également en charge :
- du suivi des demandes en "plasma convalescent - COVID-19" ;
- d'établir un bilan des demandes à l'issue de la période d'utilisation.
L'utilisation hors essai clinique est envisagée lorsque l'inclusion du patient dans un essai n'est pas (ou plus) possible, et :
- dans les mêmes indications que celles définies par les essais cliniques conduits en France ;
- dans un nombre limité de situations particulières, qui doivent faire l'objet d'une décision médicale collégiale au niveau de l'unité de soins où le patient est pris en charge.
Les patients éligibles à une thérapie par plasma doivent satisfaire les critères suivants :
- confirmation biologique de l'infection par le SARS-CoV-2,
- hospitalisation suite à des complications liées à la maladie COVID-19,
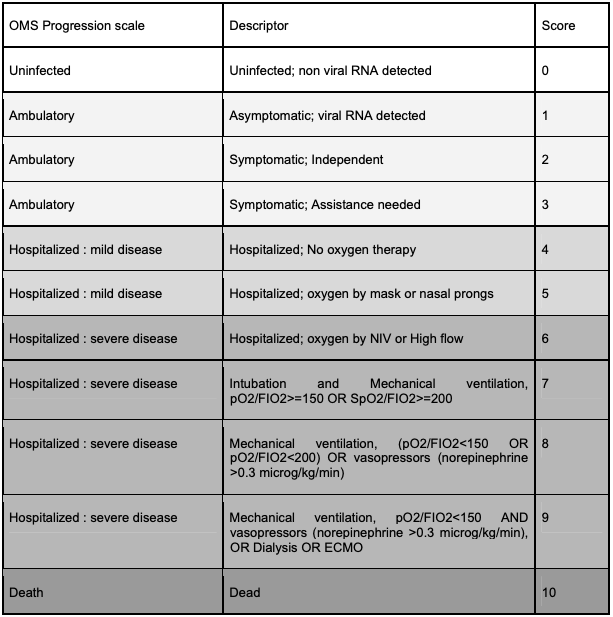
- sévérité au moins de grades 4 ou 5, tels que décrits dans l'échelle OMS (cf. Tableau I), survenant jusqu'au 10e jour après le début des symptômes cliniques. Pour les grades supérieurs à 5 ou au-delà du 10e jour après le début des symptômes, la décision de traitement par le plasma devra être prise par un collège de réanimateurs.
Tableau I - Définition des grades de sévérité de la maladie COVID-19
(OMS progression scale, 2020)
Un PUT pour accompagner les équipes soignantes
Pour accompagner les équipes soignantes dans l'utilisation du plasma chez des patients COVID-19 non inclus dans un essai clinique, l'ANSM a élaboré un protocole d'utilisation thérapeutique (PUT), en lien avec l'avis du HCSP (Haut Conseil de Santé publique) du 27 avril 2020 (non publié au 4 mai 2020).
La posologie recommandée dans le PUT est basée sur celle utilisée dans les protocoles d'essai clinique :
- transfusion d'une ou deux unités de plasma convalescent COVID-19 de 200 à 240 mL chacune en injection intraveineuse (IV) à J8 +/- 2 du début des symptômes cliniques,
- puis 1 ou 2 autres unités de plasma 24 h après soit un total de 2 à 4 unités/patient en 2 épisodes transfusionnels à un débit faible de 200 mL/heure (soit 3,5 mL/min).
Ces transfusions sont réalisées dans le respect des règles de compatibilité ABO de la transfusion plasmatique.
Pour aller plus loin
COVID-19 : L'ANSM encadre le recours possible à l'utilisation de plasma de personnes convalescentes pour des patients ne pouvant être inclus dans les essais cliniques - Point d'information (ANSM, 30 avril 2020)
Décision du 29/04/2020 autorisant la collecte, la préparation, la conservation, la distribution et la délivrance du produit sanguin labile « plasma convalescent Covid-19 » et le soumettant à des conditions particulières d'utilisation dans l'intérêt de la santé publique (ANSM, 30 avril 2020)
Protocole d'utilisation thérapeutique - Plasma convalescent COVID-19 - Infection par le coronavirus SARS-CoV-2 (maladie COVID-19) (ANSM, 30 avril 2020)
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 3 minutes
3 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.