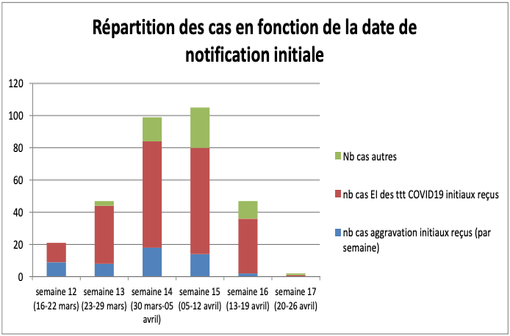
Répartition des cas d'effets indésirables en lien avec les médicaments pris dans un contexte de COVID-19 et recueillis sur le territoire national en fonction de la date de notification initiale (illustration @CRPV).
Les CRPV (Centres régionaux de pharmacovigilance) de Franche-Comté et de Bourgogne sont en charge d'analyser l'ensemble des données de pharmacovigilance en lien avec les médicaments pris dans un contexte de COVID-19, et recueillies sur le territoire national.
Le dernier rapport hebdomadaire (données arrêtées au 22 avril 2020) fait état de 321 déclarations, soit 101 cas supplémentaires par rapport au bilan précédent. Ces cas sont répartis en 3 catégories (cf. Tableau I) :
- 215 cas d'effets indésirables sous médicament utilisé pour traiter l'infection par le SARS-CoV-2,
- 51 cas correspondant à une aggravation de l'infection COVID-19,
- 55 cas correspondant à des cas autres chez des patients COVID-19 positifs ou suspects.
Tableau I - Répartition des déclarations relatives aux médicaments pris dans un contexte d'infection COVID-19
| Nb total de cas | Dont Nb de cas graves (%) | Dont Nb de décès | |
| Nombre de cas inclus | 321 (+101) | 256 (80 %) | 13 (+2) |
| Nombre de cas d'aggravation de l'infection COVID19 | 51 (+6) | 50 (98 %) | 5 (+1) |
| Nombre de cas d'effet indésirable sous médicament utilisé le traitement du COVID19 | 215 (+66) | 167 (78 %) | 4 (=) |
| Nombre de cas autres chez des patients COVID + ou suspect de COVID19 | 55 (+29) | 39 (71 %) | 4 (+1) |
Une situation grave dans 8 cas sur 10, et une prédominance masculine
- 4 % de décès,
- 76 % d'autres effets indésirables graves.
Autre constat révélé par ces données de pharmacovigilance, ces effets indésirables sont à prédominance masculine : 66 % des déclarations concernent des hommes (sexe ratio H/F = 2).
Enfin, l'âge moyen des patients est de 63 ans :
- 47,4 % des déclarations faites chez des personnes de 65 ans ou plus,
- 32,2 % chez des personnes de 50 à 64 ans,
- 20,2 % chez des personnes de 18 à 49 ans.
Effets indésirables associés au traitement de la COVID-19 : l'hydroxychloroquine reste majoritaire
Si l'on regarde la répartition des effets indésirables rapportés par substance, l'hydroxychloroquine comptabilise le plus grand nombre des déclarations (53 %) :
- hydroxychloroquine seule : 23 %,
- hydroxychloroquine plus azithromycine : 31 %.
L'analyse au 22 avril 2020 fait apparaître 34 cas supplémentaires associés à l'hydroxychloroquine par rapport aux données précédentes (115 cas au total).
La majorité (70 %) des effets indésirables sont d'ordre cardiaques (cf. Encadré 1).
Les effets indésirables d'ordre hépatique, digestif et cutané représentent respectivement 8 %, 6 % et 4 %.
Encadré 1 - Liste des effets indésirables rapportés avec l'hydroxychloroquine
|
Selon le dernier rapport du CRPV de Nice Alpes-Côtes d'Azur relatif au suivi des effets indésirables cardiaques (cf. Encadré 2), ces derniers sont associés dans plus de 80 % des cas à l'hydroxychloroquine (seule ou associée à l'azithromycine).
Encadré 2 - Répartition des effets indésirables cardiaques (dont 80 % avec l'hydroxychloroquine) - CRPV Nice 22 avril 2020
|
Effets indésirables attribués à d'autres médicaments : 42 % en lien avec l'association lopinavir/ritonavir
L'association lopinavir/ritonavir est mise en cause dans 42 % des déclarations d'effets indésirables (cf. Encadré 3).
Pour cette association antivirale, l'analyse au 22 avril 2020 fait état de 31 cas supplémentaires par rapport aux données précédentes, soit 91 cas au total.
La majorité des effets indésirables correspond à une toxicité hépatique (43) %. Les autres types d'effets indésirables rapportés avec cette association antivirale sont :
- digestifs (18 %),
- cardiaques (15 %),
- rénaux (12 %),
- autres (12 %).
Encadré 3 - Liste des effets indésirables rapportés avec l'association lopinavir/ritonavir
|
Les autres déclarations d'effets indésirables (4 %) concernent la chloroquine (3 cas), le remdésivir (3 cas), le tocilizumab et le sarilumab. Cependant, pour ces médicaments, aucun nouveau cas n'a été rapporté dans le dernier rapport.
Aggravation de l'infection à COVID-19 : une majorité de cas avec les anti-inflammatoires
Le CRPV de Dijon comptabilise 51 déclarations associant la prise de certains médicaments à des aggravations de l'infection à COVID-19. Les anti-inflammatoires sont majoritairement en jeu dans ce phénomène d'aggravation :
- AINS seuls ou associés : 24 cas,
- corticoïdes seuls ou associés : 23 cas.
Mésusage et COVID-19 : de nouveaux médicaments notifiés
L'identification des situations de mésusage des médicaments, notamment l'utilisation hors AMM chez des patients COVID-19, est une autre mission des CRPV.
Des données sont collectées via le questionnaire MESANGE (étude mise en place par les Centres Régionaux de Pharmacovigilance de Franche-Comté et de Bourgogne et ouverte à toute la France le 30 mars 2020).
Le dispositif MESANGE a permis d'identifier de nouvelles situations de mésusage pour les médicaments suivants :
- STROMECTOL (ivermectine) : 2 fois,
- SINGULAIR (montélukast) : 2 fois en début de suspicion d'infection et 1 fois après sortie de l'hôpital pour traiter les lésions pulmonaires dues au COVID-19,
- EFFIZINC : 1 fois,
- association ZECLAR (azithromycine) + OROKEN (céfixime) pour suspicion COVID-19 sans autre indication par ailleurs : 1 fois,
- association azithromycine + simvastatine (+ remontée du mésusage de l'azithromycine dans le contexte COVID sans autre indication par ailleurs) : 1 fois.
Dans tous les cas, le mésusage a pour origine une prescription :
- 17 fois par un médecin généraliste,
- 7 fois par un médecin spécialiste,
- 2 fois par un dentiste,
- 2 fois non renseigné.
Dans 17 cas, l'ordonnance n'a pas été délivrée et dans 3 cas elle a été modifiée avant délivrance.
En conclusion : une sous-notification de la toxicité cardiaque révélée et un bénéfice/risque défavorable
En 25 jours, le CRPV de Nice a comptabilisé 96 cas de toxicité cardiaque attribuables à des médicaments utilisés pour traiter l'infection à COVID-19, dont 80 % pour l'hydroxychloroquine. Rapportées aux 92 notifications de toxicité cardiaque faites depuis 1967/1981, ces nouvelles données révèlent une sous-notification majeure de ces cas.
Sur la base de l'ensemble des données de pharmacovigilance, et tenant compte de l'absence de données d'efficacité indiscutables de ces traitements dans la prise en charge de COVID-19 (au 22 avril 2020), les experts en pharmacovigilance concluent à une balance bénéfice/risque défavorable pour l'ensemble de ces médicaments, en particulier l'hydroxychloroquine, utilisés en dehors du cadre des essais cliniques.
Pour aller plus loin
Pharmacovigilance et addictovigilance dans le contexte du COVID-19 : une surveillance renforcée (ANSM, 22 avril 2020)
Suivi des effets indésirables des médicaments utilisés dans la prise en charge du COVID-19 - Chiffres clés (ANSM, 22 avril 2020)
Bilan des effets indésirables validés dans la base nationale de pharmacovigilance concernant les patients pris en charge dans le contexte d'une infection à Covid19 et des cas de mésusage - Rapport CRPV Dijon (ANSM, 25 avril 2020)
Bilan des effets indésirables validés dans la base nationale de pharmacovigilance concernant les patients pris en charge dans le contexte d'une infection à Covid19 et des cas de mésusage - Rapport CRPV Nice (ANSM, 24 avril 2020)
- AZITHROMYCINE ARROW 250 mg cp pellic
- AZITHROMYCINE BIOGARAN 250 mg cp pellic
- AZITHROMYCINE CRISTERS 250 mg cp pellic
- AZITHROMYCINE EG 250 mg cp pellic
- AZITHROMYCINE EVOLUGEN 250 mg cp pellic
- AZITHROMYCINE KRKA 250 mg cp pellic
- AZITHROMYCINE MONODOSE SANDOZ 250 mg cp pellic
- AZITHROMYCINE PFIZER 250 mg cp pellic
- AZITHROMYCINE SANDOZ 250 mg cp pellic
- AZITHROMYCINE TEVA 250 mg cp pellic
- AZITHROMYCINE ZENTIVA 250 mg cp pellic
- AZITHROMYCINE ZYDUS 250 mg cp pellic
- CEFIXIME ALMUS 200 mg cp pellic
- CEFIXIME ARROW LAB 200 mg cp pellic
- CEFIXIME BIOGARAN 200 mg cp pellic
- CEFIXIME CRISTERS 200 mg cp pellic
- CEFIXIME EG 200 mg cp pellic
- CEFIXIME EVOLUGEN 200 mg cp pellic
- CEFIXIME TEVA 200 mg cp pellic
- CEFIXIME VIATRIS 200 mg cp pellic
- CEFIXIME ZYDUS 200 mg cp pellic
- EFFIZINC 15 mg gél
- IVERMECTINE ARROW LAB 3 mg cp
- IVERMECTINE BIOGARAN 3 mg cp
- IVERMECTINE EG 3 mg cp
- IVERMECTINE PIERRE FABRE 3 mg cp
- IVERMECTINE VIATRIS 3 mg cp
- IVERMECTINE ZENTIVA 3 mg cp
- KALETRA (80 mg + 20 mg) / ml sol buv
- KALETRA 100 mg/25 mg cp pellic
- KALETRA 200 mg/50 mg cp pellic
- LOPINAVIR/RITONAVIR VIATRIS 100 mg/25 mg cp pellic
- LOPINAVIR/RITONAVIR VIATRIS 200 mg/50 mg cp pellic
- NIVAQUINE 100 mg cp séc
- NIVAQUINE 25 mg/5 ml sirop
- OROKEN 100 mg/5 ml pdre p susp buv en flacon enfant
- OROKEN 200 mg cp pellic
- OROKEN 40 mg/5 ml pdre p susp buv en flacon nourrisson
- PLAQUENIL 200 mg cp pellic
- STROMECTOL 3 mg cp
- ZECLAR 0,5 g pdre p sol diluer p perf
- ZECLAR 25 mg/ml glé p susp buv
- ZECLAR 250 mg cp pellic
- ZECLAR 50 mg/ml glé p susp buv
- ZECLAR 500 mg cp pellic
- Acné
- Angine
- Antibiotiques, antiviraux (traitement par)
- Cystite aiguë de la femme
- Diarrhée aiguë de l'adulte
- Érysipèle et autres dermohypodermites bactériennes
- Gale
- Impétigo
- Infections génitales de la femme
- Infections respiratoires basses de l'enfant
- Lyme (maladie de)
- Otite moyenne aiguë de l'enfant
- Parasitoses
- Pneumonie aiguë communautaire de l'adulte
- Polyarthrite rhumatoïde
- Pyélonéphrite aiguë de la femme
- Pyélonéphrite aiguë du nourrisson et de l'enfant
- Sinusite aiguë de l'adulte
- Ulcère gastrique ou duodénal
- Urétrite masculine
- VIH (infection par le)
- Voyages : recommandations sanitaires

 6 minutes
6 minutes 14 commentaires
14 commentaires 


L'hydroxychloroquine est aussi utilisee contre le lupus. C'est un médicament qui était en vente libre il y a encore quelques années.