Un taux d’éosinophiles élevé est très fréquemment retrouvé dans l’asthme sévère allergique de l’enfant (illustration).
Deux nouvelles présentations de NUCALA 100 mg solution injectable, un anticorps monoclonal anti-IL5 à base de mépolizumab, sont disponibles sur le marché français :
- NUCALA 100 mg solution injectable en seringue préremplie,
- NUCALA 100 mg solution injectable en stylo prérempli.
Comme la présentation en flacon, NUCALA en seringue préremplie et NUCALA en stylo prérempli sont indiqués chez l'adulte, l'adolescent et l'enfant âgé de 6 ans et plus, en traitement additionnel, dans l'asthme sévère réfractaire à éosinophiles (cf. VIDAL Recos "Asthme de l'adulte" et "Asthme de l'enfant : traitement de fond").
Des présentations adaptées uniquement à l'adulte et l'enfant à partir de 12 ans
Le stylo prérempli et la seringue préremplie de NUCALA permettent d'administrer 100 mg de mépolizumab, conformément au schéma posologique recommandé chez l'adulte et l'adolescent de 12 ans et plus : 100 mg en injection sous-cutanée 1 fois toutes les 4 semaines.
Pour cette raison, ces nouvelles présentations ne sont pas adaptées à l'utilisation chez l'enfant de 6 à 11 ans ; elles ne permettent pas d'administrer la dose de 40 mg de mépolizumab recommandée dans cette population plus jeune (40 mg 1 fois toutes les 4 semaines). La présentation en flacon doit être utilisée.
La nécessité de poursuivre le traitement par NUCALA doit être réévaluée par le médecin au minimum une fois par an, selon un rythme déterminé en fonction de la gravité de la maladie du patient et du niveau de contrôle des exacerbations.
Consignes générales à rappeler aux patients
Le stylo prérempli et la seringue préremplie de NUCALA sont prêts à l'emploi.
Trente minutes avant l'injection, le dispositif doit être sorti du réfrigérateur et retiré de la barquette dans lequel il est placé.
Le patient doit toujours vérifier la date de péremption indiquée sur le dispositif, et se laver les mains avant la manipulation.
L'auto-administration est possible avec NUCALA stylo prérempli ou NUCALA seringue préremplie, sous certaines conditions :
- le médecin a donné son accord,
- le patient a reçu une formation adéquate pour utiliser NUCALA en stylo ou seringue.
Les sites d'injection recommandés sont :
- les cuisses et l'abdomen,
- la partie supérieure du bras si l'injection est réalisée par une autre personne que le patient.
Modalités de conservation de NUCALA stylo et seringue préremplis
NUCALA doit être conservé au réfrigérateur, entre 2 et 8 °C, dans l'emballage d'origine et à l'abri de la lumière.
Cependant, le stylo prérempli et la seringue préremplie de NUCALA peuvent être sortis du réfrigérateur et conservés à température ambiante :
- dans la boîte non ouverte,
- à température ne dépassant pas 30 °C,
- à l'abri de la lumière,
- pendant 7 jours maximum.
Après ouverture de la boîte, le stylo prérempli ou la seringue préremplie doivent être administrés dans les 8 heures.
Description du stylo prérempli de NUCALA et instructions d'utilisation
Le stylo prérempli de NUCALA est muni :
- d'une fenêtre de visualisation de la solution injectable,
- d'un capuchon transparent de protection de l'aiguille.
Le stylo doit être placé selon un angle de 90° contre la surface de la peau.
L'injection sous-cutanée est réalisée en poussant le stylo contre la peau.
Un premier clic indique que l'injection a débuté. Un second clic signale la fin de l'injection.
Après le second clic, le patient doit compter jusqu'à 5 avant de retirer le stylo de la peau.
Après l'injection, la fenêtre de visualisation doit être remplie avec l'indicateur jaune.
Description de la seringue préremplie de NUCALA et instructions d'utilisation
La seringue préremplie est munie :
- d'un piston blanc,
- d'une fenêtre de visualisation de la solution,
- d'un protège-aiguille automatique (pour protéger l'aiguille après injection) et d'un capuchon de protection de l'aiguille.
La seringue doit être placée selon un angle de 45° ; la peau est légèrement pincée pendant l'injection.
Le piston blanc doit être entièrement poussé vers le bas (jusqu'à ce que le butoir atteigne le fond de la seringue) avant de relever le pouce.
Alignement du périmètre de prise en charge de toutes les présentations de NUCALA
En parallèle de la mise sur le marché de NUCALA en stylo prérempli et en seringue préremplie, le périmètre de prise en charge de NUCALA 100 mg poudre pour solution injectable en flacon a été aligné sur celui des nouvelles présentations (cf. Encadré 1) et prend en compte désormais la population pédiatrique à partir de 6 ans (cf. avis de la Commission de la Transparence du 17 juillet 2019).
L'extension d'indication chez l'enfant à partir de 6 ans a été octroyée à NUCALA en août 2018.
Dans cette population, la Commission de la Transparence (CT) a attribué à NUCALA un SMR (service médical rendu) important dans les mêmes conditions que chez l'adulte en traitement additionnel dans l'asthme sévère réfractaire à éosinophiles, en présence des critères suivants :
- un taux d'éosinophiles sanguins > ou = 300 cellules/µL dans les douze derniers mois ;
- ET
- au moins deux épisodes d'exacerbations asthmatiques ayant nécessité un traitement par corticoïde oral (> ou = 3 jours chacun) dans les douze derniers mois malgré un traitement de fond associant des corticoïdes inhalés à dose élevée et un bronchodilatateur d'action longue (LABA) (stade 4/5 GINA [Global initiative for asthma]) ;
- ou un traitement par corticothérapie orale (pendant au moins six mois au cours des douze derniers mois) sur une période prolongée.
La décision de la CT repose sur les conclusions des études d'efficacité présentées dans le dossier d'AMM :
- chez l'enfant entre 12 et 18 ans : analyse des données issues des études MENSA et MUSCA pour un sous-groupe d'adolescents (soit un total de 34 patients). D'après l'analyse agrégée de ces études, le taux d'exacerbations cliniquement significatives était de 0,94/an dans le groupe placebo et 0,56/an dans le groupe mépolizumab, soit un rapport entre les taux de réduction des deux groupes de 0,60 (IC95% [0,17 ; 2,10]). L'intervalle de confiance large et non statistiquement significatif est lié au très faible nombre d'adolescents inclus dans l'analyse. Dans le sous-groupe des adultes (soit 1 093 patients), le taux d'exacerbations était de 1,52/an dans le groupe placebo et 0,71/an dans le groupe mépolizumab, soit un rapport entre les taux de réduction des deux groupes de 0,46 (IC95% [0,38 ; 0,56]) ;
- chez l'enfant entre 6 et 11 ans : analyse des données d'une étude de pharmacocinétique/pharmacodynamique ayant montré une évolution favorable du contrôle de l'asthme (incidence des exacerbations) au cours des 12 semaines de traitement et mis en évidence des variations pharmacocinétiques et pharmacodynamiques considérées comme prévisibles au regard des paramètres observés chez l'adulte après prise en compte du poids corporel. Par ailleurs, une réduction du taux d'éosinophiles sanguins circulants comparable à l'adulte a été observée dans la population des adolescents et des enfants, dans la limite du faible nombre d'observations.
Place de NUCALA dans la stratégie thérapeutique de l'asthme
Selon la CT, "la prise en charge pharmacologique de l'asthme à long terme repose sur une approche par palier avec escalade thérapeutique en cas de non-contrôle ou de contrôle partiel de la maladie".
La stratégie d'adaptation des traitements définie par le GINA pour l'adulte, l'adolescent et l'enfant de 6 ans et plus est synthétisée dans le tableau I ci-dessous.
Tableau I - Recommandations GINA 2019 pour la prise en charge thérapeutique de l'asthme chez les adultes, les adolescents et les enfants âgés de 6 ans et plus (d'après : Global Strategy for Asthma Management and Prevention, Global Initiative for Asthma [GINA] 2019 - page 47)
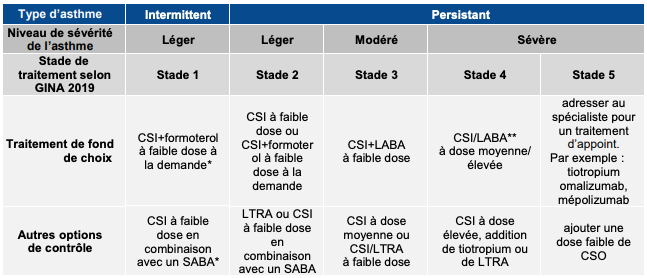

LABA : bêta-agoniste à action prolongée ; CSI : corticoïdes inhalés ; CSO : corticoïdes oraux ; LTRA : antagonistes des leucotriènes ; SABA : bêta-agoniste de courte durée d'action ; *hors AMM : données uniquement pour l'association budésonide/formotérol
Identité administrative
Identité administrative
- Liste I
- Prescription initiale hospitalière annuelle
- Prescription initiale et renouvellement réservés aux spécialistes en pneumologie
- Boîte de 1 stylo prérempli, CIP 3400930186343
- Boîte de 1 seringue préremplie, CIP 3400930186336
- Remboursable à 65 % selon la procédure des médicaments d'exception (Fiche d'information thérapeutique publiée au Journal officiel du 13 mars 2020 - texte 10) et dans un périmètre restreint (cf. Encadré 1)
- Prix public TTC = 1 012,58 euros
- Agrément aux collectivités (Journal officiel du 13 mars 2020 - texte 11)
- Laboratoire GlaxoSmithKline
Encadré 1 - Périmètre de prise en charge de NUCALA
(stylo prérempli, seringue préremplie et flacon)
(stylo prérempli, seringue préremplie et flacon)
En traitement additionnel dans l'asthme sévère réfractaire à éosinophiles chez les adultes, les adolescents et les enfants de 6 ans et plus répondant aux critères suivants :
|
| Les patients dont l'asthme n'est pas contrôlé en raison d'un traitement de fond inadapté, de problèmes d'observance, de comorbidités ou de facteurs de risque aggravants non pris en charge n'entrent pas dans ce périmètre. |
Pour aller plus loin
Avis de la Commission de la Transparence - NUCALA stylo prérempli et seringue préremplie (HAS, 20 novembre 2019)
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 7 minutes
7 minutes Ajouter un commentaire
Ajouter un commentaire





Les commentaires sont momentanément désactivés
La publication de commentaires est momentanément indisponible.