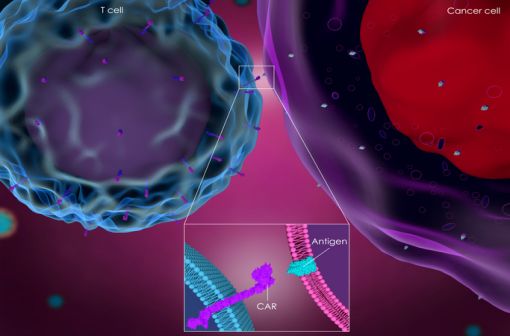
Représentation en 3D de l'interaction entre une cellule CAR T et une cellule cancéreuse (illustration).
KYMRIAH 1,2 x 106 à 6 x 108 cellules dispersibles pour perfusion (tisagenlecleucel) est le deuxième représentant de la classe des CAR-T cells avec YESCARTA 0,4-2 x 108 cellules dispersibles pour perfusion (axicabtagène ciloleucel) [notre article du 3 septembre 2019] et le premier à disposer d'une indication en pédiatrie (cf. Encadré 1).
KYMRIAH est indiqué dans le traitement :
|
KYMRIAH, nouveau représentant de thérapie génique
Thérapie anticancéreuse immunocellulaire autologue, KYMRIAH (tisagenlecleucel) a précédemment été mis à disposition dans le cadre d'ATU (autorisations temporaires d'utilisation) [cf. Encadré 2].
Encadré 2 - KYMRIAH en chiffres
|
Le principe actif de KYMRIAH correspond à des lymphocytes T autologues génétiquement modifiés ex vivo au moyen d'un vecteur lentiviral codant pour un récepteur antigénique chimérique (CAR) anti-CD19.
Les lymphocytes T reprogrammés par cette méthode ont la capacité d'identifier et d'éliminer les cellules exprimant le CD19 impliquées dans certains cancers hématologiques.
Lors de sa liaison aux cellules exprimant le CD19, le CAR transmet un signal favorisant l'expansion des lymphocytes T et la persistance de tisagenlecleucel.
Évaluation de KYMRIAH dans le traitement de la LAL
La Commission de la Transparence a évalué l'efficacité et la tolérance de KYMRIAH dans le traitement de la LAL sur la base principalement de 2 études de phase II non comparatives (cf. avis du 12 décembre 2018), l'étude pivot ELIANA (Maud SL et Coll. N Engl J Med 2018) et l'étude supportive ENSIGN.
Selon les résultats de ces études, le pourcentage de rémissions complètes à 3 mois est élevé, de l'ordre de 67 % de la population en intention de traiter (ITT), et maintenu chez environ 40 % des patients après un suivi médian de 9 mois, les patients, âgés de 12 ans en moyenne, étant en majorité lourdement prétraités et dans des situations cliniques pour lesquelles les options thérapeutiques sont limitées et ne permettent pas d'envisager une rémission complète.
La tolérance de KYMRIAH est marquée par des risques importants de syndrome de relargage des cytokines, à hauteur de 77,2 % dans l'étude ELIANA (cf. Encadré 3), d'infections, de toxicité neurologique grave, de syndrome de lyse tumorale, de déplétion prolongée en cellules B (hypogammaglobulinémie) et de cytopénie non résolue au 28e jour.
| Le syndrome de relargage des cytokines (CRS) résulte de la lyse massive des cellules tumorales ayant pour conséquence le relargage massif de cytokines effectrices, telles que IFN gamma, TNF alfa et IL2. Celles-ci activent à leur tour le système monocyte/macrophage, entraînant la production de cytokines pro-inflammatoires (dont IL6, IFN-gamma, IL10, MCP1) associée à une élévation importante de la CRP et de la ferritine. Ce syndrome peut être à l'origine de neurotoxicité, voire de décès. En général, le CRS apparaît entre 1 et 14 jours après l'injection et peut durer de 1 à 10 jours. Il peut être à l'origine de neurotoxicité, voire de décès. |
Sur la base de ces données, la Commission a attribué un SMR important à KYMRIAH et une amélioration du SMR modérée (ASMR III) dans la stratégie de prise en charge des enfants et jeunes adultes jusqu'à 25 ans atteints de LAL B réfractaire, en rechute après greffe ou après la 2e rechute ou plus. Dans cette indication, la Commission considère que la place de KYMRIAH dans la stratégie thérapeutique est celle d'un traitement de 1re intention.
La Commission a tenu compte dans cet avis "des incertitudes sur la quantité d'effet de KYMRIAH faute de comparaison directe avec la prise en charge habituelle", difficilement réalisable, "et sur le maintien de l'efficacité clinique à plus long terme" ainsi que "de la toxicité significative à court terme et l'absence de données de tolérance à long terme".
La HAS (Haute Autorité de Santé) prévoit une réévaluation annuelle de KYMRIAH, notamment pour prendre en compte les nouvelles données issues des essais cliniques et de l'utilisation en vie réelle.
Évaluation de KYMRIAH dans le traitement du LDGCB
Dans un autre avis du 12 décembre 2018, la Commission de la Transparence a par ailleurs évalué l'efficacité de KYMRIAH dans le traitement du lymphome diffus à grandes cellules B (LDGCB) sur la base principalement de deux études pivot de phase II non comparatives, l'étude pivot JULIET (Schuster SJ et Coll. N Engl J Med 2018) et l'étude supportive monocentrique A2101J (Schuster SJ et Coll. N Engl J Med 2017).
Selon les résultats de ces études, les données d'efficacité montrent un pourcentage de réponses complètes de l'ordre de 24,2 % dans la population en ITT et un taux de survie à 12 mois d'environ 40 % avec un suivi médian limité à 7 mois, dans des situations cliniques engageant le pronostic vital avec des options thérapeutiques limitées ne permettant pas d'envisager une rémission.
En termes de tolérance, le profil de KYMRIAH est marqué par un syndrome de relargage des cytokines (57,4 % dont 22,6 % de grade > ou = 3), des effets neurologiques (grade > ou = 3 dans 11,3 % des cas), des neutropénies fébriles (14,8 % des patients), des infections (19 % de grade > ou = 3) et des déplétions en cellules B (14 % des patients).
Sur la base de ces données, la Commission de la Transparence a attribué à KYMRIAH un SMR important et une amélioration du SMR mineure (ASMR IV) "en termes d'efficacité par rapport à la prise en charge historique du LDGCB réfractaire ou en rechute, après au moins deux lignes de traitement systémique, fondée sur diverses chimiothérapies".
Cet avis tient compte de la persistance d'inconnues ou d'incertitudes, notamment en termes de quantité d'effet, faute de comparaison directe avec la prise en charge habituelle, difficilement réalisable, de maintien de l'efficacité et de tolérance sur le long terme.
La Commission place KYMRIAH comme traitement de 3e ligne ou plus du LDGCB chez les patients en échec à au moins 2 lignes de traitements systémiques avec un antécédent de greffe autologue pour les patients qui y étaient éligibles.
Comment se présente KYMRIAH ?
KYMRIAH dispersion pour perfusion se présente en poche pour perfusion (éthylène acétate de vinyle) avec une tubulure en chlorure de polyvinyle (PVC) et un interconnecteur à luer/perforateur fermé par un capuchon de type luer-lock.
Chaque poche contient soit 10 à 30 mL (poches de 50 mL), soit 30 à 50 mL (poches de 250 mL) de dispersion cellulaire.
Chaque poche est placée dans une cassette d'aluminium, puis mise dans un sac enveloppant en plastique avec feuillets absorbants et scellée dans une enveloppe de protection (Tyvek).
Une dose individuelle de traitement comprend 1 à 3 poches (soit un total de 1,2 x 106 à 6 x 108 lymphocytes T).
- Conservation et transport à - 120 °C
Après décongélation, le produit doit être administré immédiatement. Le produit doit être gardé à température ambiante (20 °C - 25 °C) et perfusé dans les 30 minutes, afin de maintenir au maximum la viabilité du produit, en tenant compte de toute interruption au cours de la perfusion.
Où est fabriqué/utilisé KYMRIAH ?
Le centre de production CELLforCURE de Novartis, où sont préparés les CAR-T cells, est basé en France (Ulis, Essonne).
La fabrication et la libération de KYMRIAH prend habituellement 3 à 4 semaines.
Chaque médicament KYMRIAH est produit pour un patient à partir de ses propres cellules T, prélevées par leucaphérèse et génétiquement modifiées. Les cellules viables positives pour le CAR T anti-CD19 sont amplifiées et sont reperfusées au patient, chez qui elles peuvent alors reconnaître et éliminer les cellules cibles exprimant le CD19.
L'administration de KYMRIAH est réservée aux centres qualifiés pour l'utilisation des cellules CAR-T, soit en France une quinzaine d'hôpitaux dont 4 services de pédiatrie actuellement (janvier 2020).
Le traitement doit être initié sous la direction et la supervision d'un professionnel de santé ayant de l'expérience dans le traitement des hémopathies malignes et formé à l'administration et la prise en charge des patients traités par KYMRIAH.
KYMRIAH en pratique : usage autologue et perfusion IV
KYMRIAH est réservé :
- à un usage autologue uniquement ;
- à l'usage par voie intraveineuse exclusivement, sous la forme d'une perfusion. Le rythme de la perfusion est compris entre 10 et 20 mL par minute, avec écoulement par gravité.
Tout le contenu de la poche doit être perfusé.
- Instructions pour l'amorçage et la fin de perfusion
Lorsque le volume complet de KYMRIAH a été perfusé, la poche pour perfusion doit être rincée avec 10 à 30 mL de solution pour injection de chlorure de sodium 9 mg/mL (0,9 %) saline normale par amorçage retour pour s'assurer que le plus de cellules possibles soient perfusées au patient.
- Coordination entre l'étape de décongélation et la préparation du patient
- confirmation à l'avance de l'heure de début de la perfusion ;
- ajuster la décongélation de sorte que KYMRIAH soit disponible pour la perfusion lorsque le receveur est prêt.
Une fois que KYMRIAH est décongelé et qu'il est à température ambiante (20 °C - 25 °C), le produit doit être perfusé dans les 30 minutes afin de maintenir au maximum la viabilité du produit, en incluant toute interruption au cours de la perfusion.
- Préparation du patient : injection d'une chimiothérapie lymphodéplétive
Encadré 4 - Produits recommandés pour réaliser la chimiothérapie lymphodéplétive
|
KYMRIAH doit être administré entre 2 et 14 jours après la fin de la chimiothérapie lymphodéplétive.
La disponibilité de KYMRIAH doit donc être confirmée avant de débuter la chimiothérapie lymphodéplétive.
Si l'intervalle est supérieur à 4 semaines entre la fin de la chimiothérapie lymphodéplétive et la perfusion, et si le taux de globules blancs est supérieur à 1000 cellules/µL, il convient de retraiter le patient par une chimiothérapie lymphodéplétive avant l'administration de KYMRIAH.
- Prémédication du patient : paracétamol et anti-histaminique
- paracétamol,
- diphénhydramine (ou un autre antihistaminique H1).
Posologie de KYMRIAH : en fonction de l'indication, voire du poids pour certains patients
La posologie recommandée dépend de l'indication, voire du poids corporel du patient :
- Posologie chez les enfants et les jeunes adultes atteints de LAL à cellules B :
- poids corporel de 50 kg et moins : de 0,2 à 5 x 106 lymphocytes T viables porteurs d'un CAR/kg de poids corporel,
- poids corporel de plus de 50 kg : de 0,1 à 2,5 x 108 lymphocytes T viables porteurs d'un CAR (indépendamment du poids).
- Posologie chez les adultes atteints de LDGCB :
- de 0,6 à 6 x 108 lymphocytes T viables porteurs d'un CAR (indépendamment du poids).
Surveillance du patient en post-perfusion : le seuil des 10 jours
La surveillance des patients portent sur :
- le syndrome de relargage des cytokines (cf. Encadré 5),
- des évènements neurologiques,
- d'autres toxicités.
Une surveillance quotidienne doit être mise en place chez les patients les 10 premiers jours suivant la perfusion.
Les médecins doivent envisager une hospitalisation les 10 premiers jours après la perfusion ou aux premiers signes/symptômes d'un syndrome de relargage des cytokines et/ou d'évènements neurologiques.
Après les 10 premiers jours suivant la perfusion, la surveillance du patient doit être réalisée à la discrétion du médecin.
Les patients doivent être informés de leur obligation à rester à proximité d'un établissement médical qualifié pendant au moins 4 semaines suivant la perfusion.
Encadré 5 - Les symptômes du syndrome de relargage des cytokines
|
Identité administrative
- Liste I
- Réservé à l'usage hospitalier
- Prescription réservée aux spécialistes en hématologie ou aux médecins compétents en maladies du sang
- Surveillance particulière pendant le traitement
- Poches pour perfusion, maximum de 50 mL en fonction du patient, conditionnement en 1 à 3 poches, CIP 3400955057819, UCD 3400894399384 (poche)
- Agrément aux collectivités (Journal officiel du 26 décembre 2019 - texte 21)
- Prise en charge en sus des GHS : prise en charge subordonnée au recueil et à la transmission des informations définies dans l'arrêté du 20 décembre 2019 (Journal officiel du 26 décembre 2019 - texte 24 et texte 25)
- Laboratoire Novartis Pharma
Avis de la Commission de la Transparence - KYMRIAH : traitement de la LAL (HAS, 12 décembre 2018)
Avis de la Commission de la Transparence - KYMRIAH : traitement de la LDGCB (HAS, 12 décembre 2018)
Les études pivots :
Maud SL et al. Tisagenlecleucel in Children and Young Adults with B-Cell Lymphoblastic Leukemia. N Engl J Med 2018; 378: 439-48.
Schuster SJ, Bishop MR, Tam CS et al. Tisagenlecleucel in Adult Relapsed or Refractory Diffuse Large B-Cell Lymphoma. New Engl J Med. 2018 Dec 1
Schuster SJ, Svoboda J, Chong EA, et al. CAR-T cells (CTL019) in refractory B-cell lymphomas. New Engl J Med. 2017 ; 377:2545-54

 10 minutes
10 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.