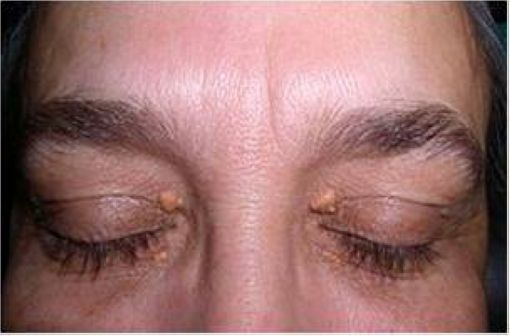
Le xanthelasma palpebrarum désigne des dépôts de cholestérol sous forme de plaques jaunâtres au-dessus des paupières, plus courantes en cas d'hypercholestérolémie familiale (illustration @Klaus D. Peter sur Wikimedia).
Une nouvelle spécialité hypolipémiante est proposée dans le traitement de l'hypercholestérolémie primaire (non familiale et familiale hétérozygote) : TWICOR comprimé, une association fixe de rosuvastatine (inhibteur de la HMG-CoA réductase) et d'ézétimibe (agent hypolipidémiant).
TWICOR est disponible sous 2 dosages :
- TWICOR 10 mg/10 mg, soit 10 mg de rosuvastatine et d'ézétimibe, en comprimé pelliculé rond de 10,1 mm ;
- TWICOR 20 mg/10 mg, soit 20 mg de rosuvastatine et 10 mg d'ézétimibe, en comprimé pelliculé rond de 10,6 mm.
TWICOR est la deuxième association fixe de rosuvastatine et d'ézétimibe commercialisée en France, après LIPOROSA qui dispose des mêmes dosages.
À noter que les dosages disponibles ne sont pas adaptés aux situations nécessitant 5 mg ou 40 mg de rosuvastatine. Les patients chez qui une dose initiale de 5 mg est recommandée sont notamment ceux âgés de plus de 70 ans, ceux ayant une insuffisance rénale modérée (clairance de la créatinine < 60 mL/min), ceux d'origine asiatique ou encore ceux présentant des facteurs de prédisposition au développement d'une myopathie.
Un traitement adjuvant de 2e intention dans l'hypercholestérolémie primaire
TWICOR est indiqué dans le traitement de l'hypercholestérolémie primaire en complément d'un régime alimentaire chez les patients adultes convenablement contrôlés, en substitution des deux composants pris séparément de façon concomitante aux mêmes doses que dans l'association fixe (Cf. VIDAL Reco "Dyslipidémies").
Il s'agit d'un traitement de 2e intention, prescrit en relais chez des patients déjà traités et contrôlés par rosuvastatine et ézétimibe administrés de manière séparée.
Bioéquivalence démontrée entre l'association fixe et l'association libre
Dans son avis du 19 mai 2019, la Commission de la Transparence a évalué TWICOR sur la base principalement de deux études de pharmacocinétique, croisées, randomisées, ouvertes, monocentriques, réalisées chez des adultes sains de sexe masculin, ayant permis de démontrer la bioéquivalence (en prise unique) :
- entre l'association fixe rosuvastatine 10 mg/ézétimibe 10 mg et l'association libre de ces principes actifs à la même dose (étude CT13225, n = 42),
- entre l'association fixe rosuvastatine 20 mg/ézétimibe 10 mg et l'association libre de ces principes actifs à la même dose (étude RP151112, n = 72).
Le laboratoire a également présenté 3 études cliniques de phase III ayant pour objectif d'évaluer l'efficacité de l'association libre rosuvastatine/ézétimibe sur la réduction du taux de LDL-c (cf. Tableau I) : ACTE (Am J Cardiol. 2011 ; 108 : 523-30 : abstract), EXPLORER (Am J Cardiol. 2007), GRAVITY (Atherosclerosis 2014).
| ACTE | Étude andomisée, en double-aveugle, multicentrique, de 6 semaines |
| Comparaison de l'ajout d'ézétimibe 10 mg à un traitement stable par rosuvastatine 5 ou 10 mg par rapport à un doublement de la posologie de la rosuvastatine de 5 à 10 mg ou de 10 à 20 mg | |
| N = 440 patients adultes avec une hypercholestérolémie non contrôlée et à risque modéré à élevé de maladie coronaire (avec ou sans antécédents de maladie athéroscléreuse) | |
| À noter : aucune association fixe de rosuvastatine 5 mg et d'ézétimibe 10 mg n'est disponible en France | |
| EXPLORER | Étude andomisée, ouverte, multicentrique, de 6 semaines |
| Comparaison de l'association de rosuvastatine 40 mg + ézétimibe 10 mg par rapport à une monothérapie par rosuvastatine 40 mg | |
| N = 469 patients adultes avec hypercholestérolémie isolée et à haut risque cardiovasculaire (avec ou sans antécédents de maladie athéroscléreuse) | |
| À noter : l'association rosuvastatine / ézétimibe a été utilisée en 1re ligne de traitement (hors recommandation) et aucune association fixe de rosuvastatine 40 mg et d'ézétimibe 10 mg n'est disponible en France | |
| GRAVITY | Étude randomisée, ouverte, multicentrique, de 12 semaines |
| Comparaison de l'ajout d'ézétimibe 10 mg à de la rosuvastatine 10 ou 20 mg par rapport à l'ajout d'ézétimibe 10 mg à de la simvastatine 40 ou 80 mg | |
| N = 833 patients adultes avec hypercholestérolémie et risque cardiovasculaire élevé (maladie coronarienne ou risque de coronopathie équivalent) | |
| À noter : l'ézétimibe a été ajoutée aux statines indépendamment du contrôle du taux de LDL-c des patients (hors-recommandation) |
Selon les résultats de ces études cliniques, l'efficacité de l'ézétimibe en association libre à la rozuvastatine a été démontrée en termes de réduction du taux de LDL-c.
La Commission précise que "l'efficacité de l'association d'ézétimibe à la rosuvastatine a été démontrée uniquement sur un critère biologique, la réduction des taux de LDL-c ; l'efficacité en termes de morbi-mortalité n'a, à ce jour, pas été démontrée. Aucune donnée clinique permettant d'évaluer l'efficacité des associations fixes rosuvastatine 10 mg ou 20 mg + ézétimibe 10 mg n'est à ce jour disponible".
En termes de tolérance, les effets indésirables (EI) observés dans les études de pharmacoéquivalence ont été d'intensité légère à modérée, de type courbatures, fièvre, augmentation de la créatine kinase, augmentation des enzymes hépatiques.
Il n'a pas été rapporté d'EI graves, ni de décès ou d'arrêt prématuré de TWICOR.
Sur la base des données disponibles, la Commission de la Transparence estime que TWICOR apporte un service médical rendu (SMR) important, sans amélioration du SMR par rapport à la prise séparée de ses deux principes actifs aux mêmes doses (ASMR V).
TWICOR n'est pas approprié pour un traitement initial. L'instauration d'un traitement ne doit s'effectuer qu'avec les composants pris séparément et le passage à l'association fixe au dosage approprié n'est possible qu'après détermination des doses adéquates.
À noter que les dosages disponibles de TWICOR ne sont pas adaptés aux situations nécessitant 5 mg ou 40 mg de rosuvastatine. Les patients chez qui une dose initiale de 5 mg est recommandée sont notamment ceux âgés de plus de 70 ans, ceux ayant une insuffisance rénale modérée (clairance de la créatinine < 60 mL/min), ceux d'origine asiatique ou encore ceux présentant des facteurs de prédisposition au développement d'une myopathie.
Quel que soit le dosage, la dose recommandée de TWICOR est de 1 comprimé pelliculé par jour, pendant ou en dehors des repas. Le traitement par TWICOR doit être adapté en fonction :
- des taux de lipides cibles,
- de l'objectif thérapeutique recommandé,
- et de la réponse du patient.
Conseils aux patients
- Le médicament ne remplace pas le régime
- Pas de TWICOR chez la femme enceinte
Les femmes en âge de procréer doivent utiliser une contraception efficace.
- Quelques contre-indications à signaler : ciclosporine et acide fusidique
En outre, TWICOR ne doit pas être administré en même temps que des formes systémiques d'acide fusidique ou dans les 7 jours suivant l'arrêt d'un traitement par l'acide fusidique. Si le traitement par l'acide fusidique est nécessaire, le traitement par rosuvastatine doit être interrompu pendant la durée du traitement par l'acide fusidique.
Enfin, TWICOR doit être pris soit plus de 2 heures avant, soit plus de 4 heures après l'administration d'un chélateur d'acide biliaire.
Identité administrative
- Liste I
- TWICOR 10 mg/10 mg comprimé pelliculé
- Boîte de 30, CIP 3400930163887, prix public TTC = 22,06 euros
- Boîte de 90, CIP 3400930163917, prix public TTC = 60,92 euros
- TWICOR 20 mg/10 mg comprimé pelliculé
- Boîte de 30, CIP 3400930163955, prix public TTC = 24,37 euros
- Boîte de 90, CIP 3400930163979, prix public TTC = 67,12 euros
- Remboursable à 65 % (Journal officiel du 22 août 2019 - texte 21)
- Agrément aux collectivités (Journal officiel du 22 août 2019 - texte 22)
- Laboratoire Mylan
Pour aller plus loin
Avis de la Commission de la Transparence - TWICOR (HAS, 15 mai 2019)
Etudes cliniques :
Bays HE et al. Safety and efficacy of ezetimibe added on to rosuvastatin 5 or 10 mg versus up-titration of rosuvastatin in patients with hypercholesterolemia (the ACTE Study). Am J Cardiol. 2011 ; 108 : 523-30 (abstract).
Ballantyne CM et al. Efficacy and safety of rosuvastatin 40 mg alone or in combination with ezetimibe in patients at high risk of cardiovascular disease (results from the EXPLORER study). Am J Cardiol. 2007 ; 99 : 673-80.
Ballantyne CM et al. Efficacy, safety and effect on biomarkers related to cholesterol and lipoprotein metabolism of rosuvastatin 10 or 20 mg plus ezetimibe 10 mg vs. simvastatin 40 or 80 mg plus ezetimibe 10 mg in high-risk patients : Results of the GRAVITY randomized study. Atherosclerosis. 2014 ; 232 : 86-93.

 6 minutes
6 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.