Le mélanome est un cancer cutané à fort potentiel métastatique, lié à la transformation maligne de cellules pigmentaires de la peau, les mélanocytes (illustration).
Deux nouvelles spécialités antinéoplasiques indiquées, en association, dans le traitement de patients adultes attteints d'un mélanome non résécable ou métastatique porteur d'une mutation BRAF V600 (Cf. VIDAL Reco "Mélanome cutané"), sont disponibles en ville et à l'hôpital :
- BRAFTOVI 50 mg et 75 mg gélules (encorafénib),
- MEKTOVI 15 mg comprimé pelliculé (binimétinib).
L'instauration de ces traitements nécessite de déterminer au préalable le statut mutationnel BRAF du patient par un test validé : seuls les patients porteurs de la mutation BRAF V600 peuvent bénéficier de ces traitements.
Avant leur commercialisation le 27 août 2019, ces spécialités ont bénéficié d'ATU (autorisation temporaire d'utilisation) nominatives initiées en juin 2018.
 BRAFTOVI et MEKTOVI font l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité de ces médicaments. Les professionnels de santé déclarent tout effet indésirable suspecté.
BRAFTOVI et MEKTOVI font l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité de ces médicaments. Les professionnels de santé déclarent tout effet indésirable suspecté.Encorafénib et binimétinib : inhibiteurs de protéines kinases BRAF/MEK
Principe actif de BRAFTOVI, l'encorafénib est un inhibiteur de la kinase de RAF. Elle inhibe la prolifération des cellules tumorales exprimant différentes formes mutées de la kinase BRAF (V600E, D et K) par inhibition de la voie RAF/MEK/ERK. Dans les mélanomes, les mutations BRAF V600 sont les plus fréquentes (environ 38 %).
Le binimétinib, principe actif de MEKTOVI, est aussi un inhibiteur de protéines kinases, actif sur les protéines MEK1 et MEK2 (mitogen-activated extracellular signal regulated kinase) qui jouent un rôle dans l'une des principales voies de prolifération de survie cellulaire.
Certains patients atteints d'un mélanome expriment une forme mutée de la protéine BRAF responsable d'une suractivation de MEK1 et MEK2, d'où l'utilisation en association de l'encorafénib et du binimétinib (association d'inhibiteurs BRAF/MEK) pour une activité anti-tumorale accrue.
Selon les recommandations de la SFD (Société française de dermatologie), de l'ESMO (European society for medical oncology) et du NCCN (National Comprehensive Cancer Network), la prise en charge actuelle en première ligne de traitement du mélanome avancé (non résécable ou métastatique) est, en cas de mutation BRAF, une bithérapie ciblée associant un inhibiteur de BRAF et un inhibiteur de MEK.
Un gain en valeur absolu de 7,6 mois en termes de survie sans progression
Dans son avis du 12 juin 2019, la Commission de la Transparence a évalué l'efficacité et la tolérance de l'association BRAFTOVI (encorafénib) et MEKTOVI (binimétinib) sur la base principalement d'une étude de phase III randomisée, multicentrique, internationale, en ouvert (étude COLOMBUS - abstract) menée chez des patients ayant un mélanome non résécable ou métastatique et porteurs d'une mutation BRAF V600.
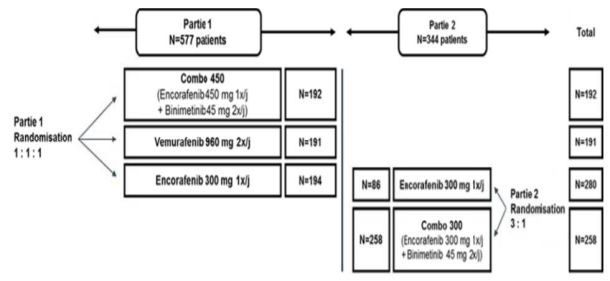
L'objectif était d'évaluer la supériorité de l'association encorafénib (450 mg dans la Partie 1 de l'étude et 300 mg dans la Partie 2 : cf. Encadré 1) et binimétinib (90 mg) par rapport au vémurafénib (1 920 mg) ou à l'encorafénib (300 mg) en monothérapie, en termes de survie sans progression (PFS) et de survie globale (OS).
Encadré 1 - Groupes de traitement de l'étude COLOMBUS
| Partie 1 Randomisation 1 :1 :1
Randomisation 3 :1
|
Le critère principal de jugement était l'évaluation de la PFS de l'association encorafénib 450 mg et binimétinib 90 mg (doses recommandées par jour d'après l'AMM) par rapport à vémurafénib 1 920 mg.
Les patients étaient répartis de la manière suivante dans les deux parties de l'étude (Figure 1) :
Figure 1 - Répartition des patients dans les deux parties de l'étude COLOMBUS
 |
Selon les résultats de cette étude, la supériorité de l'association encorafénib 450 mg/binimétinib 90 mg a été démontrée par rapport à la monothérapie avec vémurafénib sur la PFS (critère de jugement principal) : 14,9 mois (IC95 % = [11,0-18,5]) versus 7,3 mois (IC95 % = [5,6-8,2]), HR = 0,54 (IC95 % = [0,41-0,71], p < 0,0001), correspondant à un gain en valeur absolu de +7,6 mois.
S'agissant de la survie globale (critère de jugement secondaire), il n'a en revanche pas été démontré que l'association encorafénib et binimétinib apportait un gain par rapport au vemurafénib en monothérapie.
En termes de qualité de vie, les données disponibles ne permettent pas de retenir une conclusion fiable, compte-tenu du caractère ouvert de l'étude COLUMBUS.
Concernant la tolérance, les principaux risques importants du PGR (plan de gestion des risques) pour l'association encorafénib/binimétinib sont un dysfonctionnement du ventricule gauche, une hypertension artérielle, une rhabdomyolyse, un décollement de l'épithélium pigmentaire de la rétine, un thromboembolisme veineux, une hémorragie.
Prenant en compte la démonstration d'un gain sur la PFS par rapport au vemurafénib, comme pour les autres associations anti-BRAF/anti-MEK*, et malgré l'absence de démonstration sur la survie globale, contrairement aux autres associations anti-BRAF/anti-MEK* par rapport à la monothérapie par vemurafénib ou dabrafénib, la Commission de la Transparence considère que "l'association encorafénib-binimétinib est une option thérapeutique en 1re ligne de traitement de patients adultes atteints de mélanome non résécable ou métastatique porteur d'une mutation BRAF V600".
*dabrafénib/tramétinib et vémurafénib/cobimétinib
Sur la base de ces résultats, la Commission de la Transparence a attribué un SMR (service médical rendu) modéré à BRAFTOVI et à MEKTOVI, sans amélioration du SMR (ASMR V).
MEKTOVI et BRAFTOVI en pratique
La posologie recommandée est :
- une dose quotidienne totale de 90 mg de binimétinib/MEKTOVI, répartie en 2 prises de 45 mg (3 comprimés de 15 mg), à environ 12 heures d'intervalle ;
- associée à 450 mg d'encorafénib/BRAFTOVI (6 gélules de 75 mg) 1 fois par jour.
Pour chacune des molécules, des adaptations de doses sont nécessaires en présence d'effets indésirables. Une interruption temporaire ou un arrêt définitif du traitement sont décidés en fonction de la sévérité des effets secondaires.
Si le binimétinib est temporairement interrompu, la dose d'encorafénib doit être réduite à 300 mg 1 fois par jour (4 gélules de 75 mg) pendant la durée d'interruption du binimétinib.
Si le binimétinib est définitivement arrêté, l'encorafénib doit être interrompu.
A l'inverse, si l'encorafénib est temporairement interrompu, le binimétinib doit être interrompu. Si l'encorafénib est définitivement arrêté, le binimétinib doit également être définitivement arrêté.
Il convient de continuer le traitement jusqu'à ce que le patient n'en tire plus de bénéfice ou en cas de survenue d'une toxicité inacceptable.
Surveillance des patients
Compte tenu des effets secondaires potentiels de BRAFTOVI et de MEKTOVI, la surveillance des patients comportera notamment :
- sur le plan cardiovasculaire :
- l'évaluation de la fraction d'éjection ventriculaire gauche (FEVG) avant d'initier le traitement par encorafénib et binimétinib, puis 1 mois après le début du traitement, puis tous les 3 mois environ (à déterminer par le prescripteur). Ce bilan vise à identifier une dysfonction ventriculaire gauche ;
- la mesure de la pression artérielle à l'initiation du traitement et au cours du traitement,
- la réalisation d'un ECG (électrocardiogramme) avant le début du traitement, 1 mois après puis tous les 3 mois environ pour identifier un allongement de l'intervalle QTc ;
- sur le plan ophtalmologique : à chaque visite, l'évaluation des symptômes visuels. Si des symptômes indiquant l'apparition ou l'aggravation de troubles de la vision, notamment une baisse de la vision centrale, une vision trouble ou une perte de la vue, sont identifiés, il est recommandé de procéder rapidement à un examen ophtalmologique. L'encorafénib et le binimétinib exposent à une toxicité oculaire ;
- sur le plan dermatologique : la réalisation d'un examen clinique dermatologique avant le début du traitement par encorafénib en association au binimétinib, tous les 2 mois pendant le traitement et jusqu'à 6 mois après l'arrêt de celui-ci, afin d'identifier l'apparition de nouvelles tumeurs cutanées ;
- sur le plan hépatique : une élévation des transaminases ASAT et ALAT pouvant survenir avec le binimétinib, un contrôle doit être réalisé avant le début du traitement, puis au moins chaque mois pendant les 6 premiers mois de traitement, puis si cliniquement indiqué ;
- sur le plan rénal : la surveillance de la créatinine sanguine.
Conseils aux patients
Les gélules de BRAFTOVI et les comprimés de MEKTOVI s'avalent entiers avec de l'eau et peuvent être pris pendant ou en dehors des repas.
En cas d'oubli d'une dose :
- la dose de BRAFTOVI ne doit pas être prise s'il reste moins de 12 heures avant la prise de la prochaine dose prévue,
- la dose de MEKTOVI ne doit pas être prise s'il reste moins de 6 heures avant la prise de la prochaine dose prévue.
En cas de vomissements après l'administration de BRAFTOVI ou de MEKTOVI, le patient ne doit pas prendre de dose supplémentaire et prendra la prochaine dose comme initialement prévu.
Les gélules de BRAFTOVI ne doivent pas être administrées de façon concomitante avec du jus de pamplemousse (inhibiteur du CYP3A4), en raison d'un risque d'exposition accrue à l'encorafénib.
Les patients doivent veiller à avoir une bonne hydratation pendant le traitement.
Il est conseillé de ne pas s'exposer au soleil ou aux UV pendant le traitement, en raison du risque minime de photosensibilisation de binimétinib et de l'encorafénib.
BRAFTOVI peut réduire l'efficacité des contraceptifs hormonaux ; il est conseillé aux patientes qui ont recours à une contraception hormonale d'utiliser une méthode alternative ou supplémentaire telle qu'une méthode barrière (un préservatif par exemple) pendant le traitement par encorafénib et pendant au moins 1 mois après la dernière dose.
Identité administrative
- Liste I
- Prescription hospitalière réservée aux spécialistes en oncologie ou aux médecins compétents en cancérologie
- Surveillance particulière pendant le traitement
- Remboursable à 100 % (Journal officiel du 22 août 2019, texte 21)
- Agrément aux collectivités (Journal officiel du 22 août 2019, texte 22)
- BRAFTOVI :
- Dosage à 50 mg : boîte de 28 gélules, CIP 3400930156841, prix public TTC = 619,18 euros
- Dosage à 75 mg : boîte de 42 gélules, CIP 3400930156858, prix public TTC = 1 352,81 euros
- MEKTOVI 15 mg : boîte de 84 comprimé pelliculé, CIP 3400930156872, prix public TTC = 2 572,56 euros
- Laboratoire Pierre Fabre Médicament
Pour aller plus loin
Avis de la Commission de la Transparence - BRAFTOVI / MEKTOVI (HAS, 12 juin 2019)
Etude pivot :
Dummer R et Coll. Encorafenib plus binimetinib versus vemurafenib or encorafenib in patients with BRAF-mutant melanoma (COLUMBUS): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol. 2018 May ;19 (5) : 603-615 (abstract). doi: 10.1016/S1470-2045(18)30142-6. Epub 2018 Mar 21.
Recommandations :
Thésaurus Recommandations et référentiels. Patients atteints de mélanome de stade III inopérable ou de stade IV. Société Française de Dermatologie. Septembre 2017
Dummer R, Hauschild A, Lindenblatt N et al. ESMO Guidelines Committee. Cutaneous melanoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2015; 26:126-32.
NCCN National Comprehensive Cancer Network, Clinical Practice Guidelines in Oncology, Cutaneous Melanoma, Version 2.2019. Avril, 2019
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 8 minutes
8 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.