La rectocolite hémorragique (RCH) fait partie des deux principales Maladies Inflammatoires Chroniques de l'Intestin (MICI) avec la maladie de Crohn (illustration).
L'inhibiteur des Janus Kinases (anti-JAK 1 et anti-JAK 3), XELJANZ comprimé pelliculé est désormais commercialisé sous un nouveau dosage à 10 mg de tofacitinib, en complément de XELJANZ 5 mg comprimé pelliculé.
XELJANZ 10 mg comprimé pelliculé est indiqué dans le traitement de la rectocolite hémorragique (RCH) active modérée à sévère chez les patients adultes ayant présenté une réponse inadéquate, une perte de réponse ou une intolérance soit au traitement conventionnel, soit à un agent biologique (Cf. VIDAL Reco "Rectocolite hémorragique").
Évaluation du tofacitinib dans la rectocolite hémorragique
Le tofacitinib est le 1er anti-JAK examiné par la Commission de la Transparence (CT) dans la RCH, ayant la particularité de s'administrer par voie orale contrairement aux biothérapies disponibles qui s'administrent par voie parentérale (IV ou SC).
Dans son avis du 5 mars 2019, la CT a évalué XELJANZ dans la RCH sur la base principalement de deux études contrôlées versus placebo, randomisées, en double-aveugle et multicentriques (OCTAVE Induction 1 et OCTAVE Induction 2) ayant comparé l'efficacité et les effets indésirables du tofacitinib en traitement d'induction de la RCH, selon une même méthodologie (Cf. Figure 1), chez des patients en échec à au moins un traitement conventionnel (5-aminosalyclés, corticoïdes, immunomodulateurs) ou en échec à un anti-TNF (infliximab, adalimumab).
Figure 1 - Représentation schématique des différentes études OCTAVE
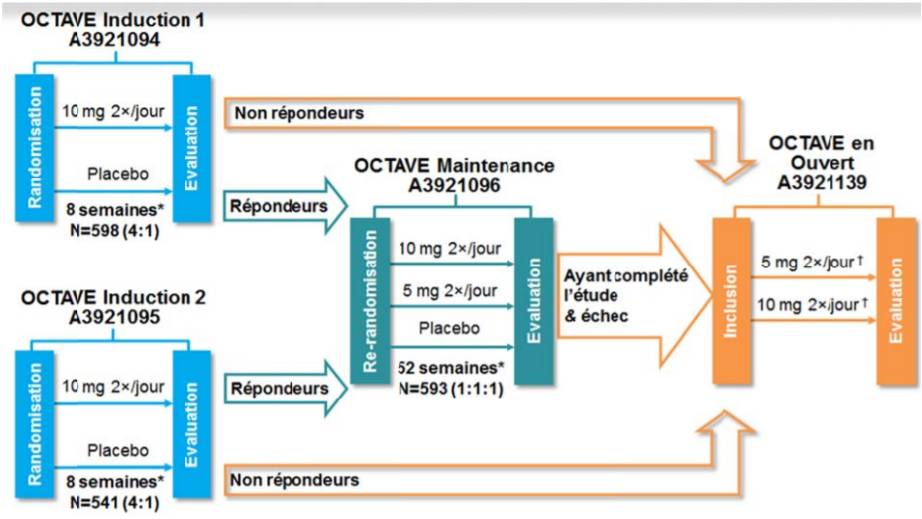
Ces études ont été prolongées par :
- une étude contrôlée versus placebo, randomisée, en double-aveugle, multicentrique (OCTAVE Maintenance) ayant comparé l'efficacité et les effets indésirables du tofacitinib en traitement de maintien de la RCH. Les patients inclus ont été les patients ayant eu une réponse clinique dans les études OCTAVE 1 ou OCTAVE 2 ;
- une étude de suivi, ouverte (OCTAVE Open), toujours en cours au moment de l'évaluation par la HAS, ayant pour objectif principal d'évaluer la tolérance à long terme du tofacitinib. Les patients inclus devaient avoir participé à au moins l'une des études précédentes (OCTAVE Maintenance et/ou OCTAVE 1 ou OCTAVE 2).
Selon les résultats de ces études, la supériorité du tofacitinib 10 mg versus placebo a été démontrée en termes d'induction de la rémission clinique à 8 semaines (Cf. Encadré 1) ainsi que de maintien de cette rémission jusqu'à 52 semaines chez des patients soit en échec à un traitement conventionnel (2e ligne), soit en échec à un traitement conventionnel et à un anti-TNF (3e ligne), avec une quantité d'effet supplémentaire jugée modérée par la Commission.
Encadré 1 - Proportion de patients ayant eu une rémission après 8 semaines de traitement - Etudes OCTAVE 1 et 2
|
En termes de tolérance, les évènements indésirables les plus fréquemment rapportés chez les patients recevant tofacitinib 10 mg au cours des études d'induction ont été des céphalées, des rhinopharyngites, des nausées et des arthralgies. Au cours des 2 études d'induction et de l‘étude d'entretien, l'effet indésirable grave le plus fréquent a été l'aggravation de la RCH.
Le recul d'utilisation étant faible, les données à long terme sont limitées. Le plan de gestion des risques (PGR) de XELJANZ dans la RCH, commun à la polyarthrite rhumatoïde, prévoit le suivi :
- de risques identifiés importants : infections, réactions d'hypersensibilité et neutropénie,
- de risques potentiels importants : maladies inflammatoires digestives telles que la maladie de Crohn et la colite ulcérative, événements majeurs cérébraux/cardiovasculaires et cancers.
SMR important, ASMR mineure, comme le védolizumab
Sur la base des données disponibles, la Commission considère que, dans le traitement de la RCH active modérée à sévère, XELJANZ apporte un service médical rendu (SMR) important chez les patients en échec (réponse insuffisante, perte de réponse ou intolérance) au traitement conventionnel (par amino-5 salicylés, corticoïdes et immunosuppresseurs) et aux anti-TNF.
Dans cette indication, la CT considère que XELJANZ (tofacitinib) apporte une amélioration du service médical rendu mineure (ASMR IV), comme ENTYVIO (védolizumab) qui s'administre par voie parentérale.
Chez les patients ayant une réponse inadéquate, une perte de réponse ou une intolérance au traitement conventionnel (c'est-à-dire les patients naïfs d'anti-TNF), le SMR de XELJANZ est en revanche considéré comme insuffisant pour justifier d'une prise en charge par la solidarité nationale au regard des alternatives existantes. Dans cette indication (2e ligne de traitement), la Commission estime que le besoin médical est actuellement couvert par les anti-TNF et prend en compte l'absence de comparaison directe du tofacitinib à un anti-TNF, alors que cette comparaison était réalisable.
Au total, la Commission considère que le tofacitinib représente une alternative au védolizumab en 3e ligne de traitement chez les patients en échec au traitement conventionnel et aux anti-TNF. Le choix se fera en concertation avec le patient et ses préférences, en tenant compte notamment des modalités d'administration différentes de ces deux médicaments et de leur profil de tolérance :
- tofacitinib : voie orale en 2 prises par jour avec nécessité d'une surveillance biologique régulière (Cf. Tableau I) ;
- védolizumab : voie parentérale par perfusion IV, suivie de perfusions supplémentaires à 2 semaines, 6 semaines, puis toutes les 8 semaines.
Tableau I – Paramètres biologiques devant être surveillés et conditionnant la prescription du tofacitinib (d'après Commission de la Transparence - Avis du 20 mars 2019)
| Enzymes hépatiques | Des précautions doivent être prises lors de l'initiation du traitement avec tofacitinib chez les patients ayant des élévations de l'alanine aminotransférase (ALAT) ou de l'aspartate aminotransférase (ASAT), en particulier en cas d'administration concomitante avec des médicaments potentiellement hépatotoxiques tels que le méthotrexate. |
| Neutropénie | Il n'est pas recommandé d'initier le traitement avec tofacitinib chez les patients présentant une numération absolue des neutrophiles (NAN) inférieure à 1 000 cellules/mm3. |
| Hémoglobinémie | Il n'est pas recommandé d'initier le traitement avec tofacitinib chez les patients présentant un taux d'hémoglobine inférieur à 9 g/dL. |
| Lipides | Le tofacitinib a été associé à des élévations des paramètres lipidiques, incluant le cholestérol total, le cholestérol des lipoprotéines de basse densité (LDL) et le cholestérol des lipoprotéines de haute densité (HDL). |
XELJANZ 10 mg comprimé en pratique
Le traitement doit être initié et surveillé par un médecin spécialiste ayant l'expérience du diagnostic et du traitement des affections pour lesquelles tofacitinib est indiqué.
Pour les patients n'ayant pas obtenu un bénéfice thérapeutique adéquat à la semaine 8, la dose d'induction peut être prolongée pendant 8 semaines supplémentaires (16 semaines au total).
Le traitement d'induction avec tofacitinib doit être interrompu chez tout patient ne montrant aucun signe de bénéfice thérapeutique à la semaine 16.
Pour certains patients, comme ceux chez qui un traitement antérieur par un anti-TNF a échoué, la poursuite de l'administration d'une dose de 10 mg deux fois par jour pour le traitement d'entretien doit être envisagée afin de conserver le bénéfice thérapeutique.
Les patients présentant une diminution de la réponse sous traitement d'entretien avec tofacitinib 5 mg administré deux fois par jour peuvent bénéficier d'une augmentation posologique avec tofacitinib 10 mg administré deux fois par jour.
Chez les patients qui ont répondu au traitement avec tofacitinib, les corticostéroïdes peuvent être réduits et/ou interrompus conformément au cadre des soins habituels.
Sécurité d'emploi du tofacitinib à 10 mg 2 fois par jour
En juin 2019, l'ANSM a émis des recommandations relatives à l'utilisation du tofacitinib à la posologie de 10 mg 2 fois par jour (notre article du 11 juin 2019).
Les médecins ne doivent plus utiliser XELJANZ à la dose de 10 mg 2 fois par jour chez les patients présentant un ou plusieurs facteurs de risque d'embolie pulmonaire, tels que :
- une insuffisance cardiaque,
- un trouble héréditaire de la coagulation,
- un risque thromboembolique,
- un contraceptif oral ou un traitement hormonal de substitution,
- un cancer,
- une chirurgie lourde programmée.
Cette restriction est consécutive aux résultats d'une étude clinique (étude A3921133) mettant en évidence une incidence globale d'embolies pulmonaires par patient-année 6 fois plus élevé dans le groupe tofacitinib 10 mg 2 fois par jour que dans le groupe contrôle anti-TNF, et 3 fois plus élevée que celle observée dans les autres études du programme tofacitinib.
Une analyse européenne des données de cet essai est en cours.
XELJANZ 5 mg comprimé : extension de prise en charge dans la rectocolite hémorragique et le rhumastisme psoriasique
Selon un arrêté du 25 juin 2019 et en parallèle de la commercialisation de XELJANZ 10 mg comprimé, le périmètre de prise en charge de XELJANZ 5 mg comprimé a été aligné pour inclure le remboursement dans l'indication "rectocolite hémorragique" (Cf. Tableau II).
Tableau II - Indications thérapeutiques de XELJANZ 5 mg et 10 mg comprimés
| Comprimé à 5 mg | Comprimé à 10 mg |
| Rectocolite hémorragique | |
|
_
|
Identité administrative
- Liste I
- Prescription initiale hospitalière annuelle
- Prescription initiale et renouvellement réservés aux spécialistes en hépato-gastro-entérologie
- Boîte de 56, CIP 3400930159453
- Remboursable à 65 % selon la procédure des médicaments d'exception (Fiche d'information thérapeutique publiée au Journal officiel du 2 juillet 2019 - texte 6) dans le traitement de la rectocolite hémorragique (RCH) active modérée à sévère chez les patients adultes ayantprésenté une réponse inadéquate, une perte de réponse ou une intolérance au traitement conventionnel et à un agent biologique.
- Prix public TTC = 1 360,66 euros
- Agrément aux collectivités (Journal officiel du 2 juillet 2019 - texte 7)
- Laboratoire Pfizer
Pour aller plus loin
Avis de la Commission de la Transparence - XELJANZ 10 mg (HAS, 20 mars 2019)
Étude pivot :
Sandborn WJ et al. Tofacitinib as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2017 ; 376 ; 18 : 1723-1736
Sur VIDAL.fr
XELJANZ (tofacitinib) : restriction d'utilisation en cas de risque élevé d'embolie pulmonaire (11 juin 2019)
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 8 minutes
8 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.