Représentation en 3D d'un cancer de l'ovaire (illustration).
ZEJULA 100 mg gélule est un antinéoplasique dont le principe actif, le niraparib, est un nouvel inhibiteur des enzymes PARP (poly-ADP ribose polymérase) PARP-1 et PARP-2, qui jouent un rôle dans la réparation de l'ADN (Cf. Encadré 1).
Encadré 1 - Mécanisme d'action et effets pharmacodynamiques du niraparib
| Des études in vitro ont montré que la cytotoxicité induite par le niraparib peut impliquer l'inhibition de l'activité enzymatique de PARP et la formation accrue de complexes ADN-PARP, provoquant des dommages à l'ADN, l'apoptose et la mort cellulaire. Une cytotoxicité accrue induite par le niraparib a été observée dans les lignées de cellules tumorales avec ou sans déficit en gènes suppresseurs de tumeur BRCA 1 et 2 (Breast Related CAncer). Dans un modèle orthotopique, chez la souris, de xénogreffe de tumeurs dérivées de patientes (PDX) atteintes d'un cancer de l'ovaire séreux, le niraparib a montré une réduction de la croissance de la tumeur chez les mutants BRCA 1 et 2, BRCA sauvage, mais avec déficit en recombinaison homologue (HR) et pour les tumeurs avec BRCA sauvage et sans déficit détectable en HR. |
ZEJULA est indiqué en monothérapie dans le traitement d'entretien de patientes adultes atteintes d'un cancer épithélial séreux de haut grade de l'ovaire, des trompes de Fallope ou péritonéal primitif, sensible au platine et récidivant, qui sont en réponse (complète ou partielle) à une chimiothérapie à base de platine.
Dans cette indication, la Haute Autorité de Santé (HAS) considère que la place de ZEJULA est celle d'un traitement d'entretien à partir de la 2e ligne, indépendamment du statut BRCA (Cf. avis du 13 juin 2018).
ZEJULA a reçu une autorisation de mise sur le marché (AMM) européenne en 2017.
Avant d'être commercialisé, il a bénéficié d'une autorisation temporaire d'utilisation (ATU) de cohorte et d'une ATU nominative.
Il est désormais disponible sur le marché français, en ville et à l'hôpital, avec un remboursement à 100 %.
 ZEJULA fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
ZEJULA fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.Prolongation de la survie sans progression par rapport au placebo
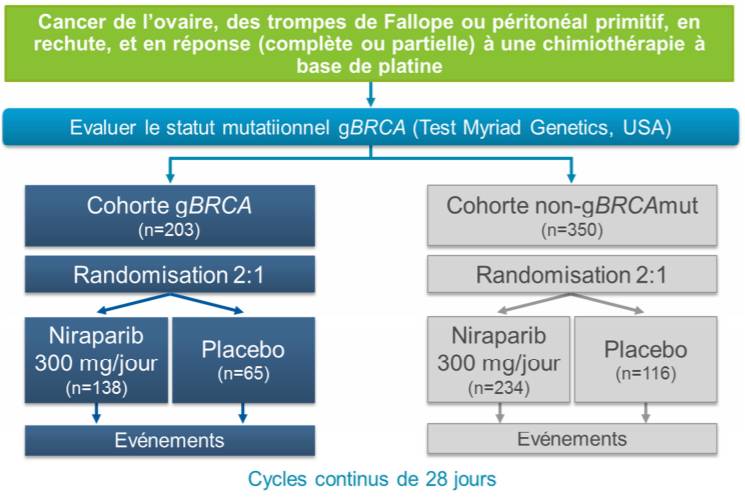
Dans son avis du 13 juin 2018, la Commission de la Transparence a évalué ZEJULA sur la base d'un essai de phase III, randomisé, en double-aveugle, comparatif versus placebo : l'étude ENGOT-OV16/NOVA.
Les patientes incluses (n = 553) présentaient une récidive de cancer épithélial séreux principalement de haut grade de l'ovaire, des trompes de Fallope, ou péritonéal primitif, sensible au schéma thérapeutique à base de platine (sensibilité définie par la survenue d'une rechute plus de 6 mois après leur avant-dernière ligne de traitement à base de platine) et en réponse complète ou partielle à la dernière ligne de chimiothérapie à base de platine.
Deux cohortes de patientes ont été formées, selon la présence ou non d'une mutation du gène BRCA (gBRCA) :
- cohorte gBRCA : avec mutation germinale ou une variante génétique du gène BRCA ou une délétion suspecte (suivi médian de 16,4 mois),
- cohorte non-gBRCA : sans mutation germinale (suivi médian de 17,5 mois).
Le critère de jugement principal était la survie sans progression évaluée par un Comité de revue indépendant et définie par la durée entre la date de randomisation et la date de progression de la maladie ou du décès quelle qu'en soit la cause.
La schéma de l'étude est représenté sur la figure 1.
Figure 1 - Schéma de l'étude ENGOT-OV16/NOVA (extrait de l'avis de la CT du 13 juin 2019)
Selon les résultats de cette étude (Cf. Tableau I), la supériorité du niraparib a été démontrée par rapport au placebo en termes de survie sans progression, avec une quantité d'effet variable selon le statut mutationnel BRCA : + 5,4 mois dans la cohorte non-gBRCA et + 15,5 mois dans la cohorte gBRCA (en valeurs absolues).
Tableau I - Survie sans progression - Etude ENGOT-OV16/NOVA
A la date d'analyse, il n'a pas été observé de différence en termes de survie globale entre les groupes des deux cohortes gBRCA et non-gBRCA (la médiane de survie globale n'a été atteinte dans aucun des groupes comparés).
La Commission fait remarquer que "le profil des patientes incluses dans l'étude diffère de celui en pratique clinique quant à l'utilisation antérieure du bévacizumab notamment en première ligne qui concerne environ deux tiers des patientes en France, alors que dans l'étude, son utilisation antérieure était limitée à un quart des patientes".
En termes de tolérance, l'incidence des arrêts de traitement pour événements indésirables (EI) a été de 15 % dans le groupe niraparib versus 2 % dans le groupe placebo.| Cohorte gBRCA | Cohorte non-gBRCA | |||
| Niraparib (n = 138) |
Placebo (n = 65) |
Niraparib (n = 234) |
Placebo (n = 116) |
|
| Survie sans progression (critère de jugement principal) | 21 mois | 5,5 mois | 9,3 mois | 3,9 mois |
| HR = 0,27 IC95 % : [0,173 ; 0,410] p < 0,0001 |
HR = 0,45 IC95 % : [0,338 ; 0,607] p < 0,0001 |
|||
| Premier traitement post progression (critère secondaire) | 21,0 mois | 8,4 mois | 11,8 mois | 7,2 mois |
| HR = 0,31 IC95 % : [0,205 ; 0,481] | HR = 0,55 IC95 %: [0,412 ; 0,721] | |||
A la date d'analyse, il n'a pas été observé de différence en termes de survie globale entre les groupes des deux cohortes gBRCA et non-gBRCA (la médiane de survie globale n'a été atteinte dans aucun des groupes comparés).
La Commission fait remarquer que "le profil des patientes incluses dans l'étude diffère de celui en pratique clinique quant à l'utilisation antérieure du bévacizumab notamment en première ligne qui concerne environ deux tiers des patientes en France, alors que dans l'étude, son utilisation antérieure était limitée à un quart des patientes".
L'incidence des EI de grades 3 ou plus a été de 74,1 % dans le groupe niraparib, soit près de 3/4 des patientes, et de 22,9 % dans le groupe placebo.
Les principaux EI graves considérés comme reliés au traitement ont été la thrombocytopénie (10,9 % vs 0) et l'anémie (3,8 % vs 0).
Considérant l'ensemble des données disponibles, la Commission a attribué à ZEJULA un service médical rendu (SMR) important et une amélioration du SMR mineure (ASMR IV) par rapport au placebo dans l'indication de l'AMM.
La place du niraparib vis-à-vis de l'olaparib (LYNPARZA), le comparateur cliniquement pertinent de ZEJULA dans le traitement d'entretien d'un cancer ovarien par un inhibiteur du PARP en cas de mutation du gène BRCA, n'est pas déterminée en raison de l'absence de données comparatives.
ZEJULA en pratique
La dose est de 3 gélules de 100 mg 1 fois par jour (dose quotidienne totale de 300 mg).
Les patientes doivent être encouragées à prendre leur dose à peu près à la même heure chaque jour. L'administration au coucher est une méthode possible pour gérer les nausées.
La dose de ZEJULA doit être ajustée, ou le traitement interrompu, en cas de survenue d'effets indésirables.
Chez les patientes de faible poids corporel, l'incidence des EI de grade 3 ou 4 étant plus élevée que chez celles présentant un poids élevé, une dose initiale de 200 mg pour les patientes pesant moins de 58 kg peut être envisagée.
Il est recommandé de poursuivre le traitement jusqu'à progression de la maladie.
Surveillance particulière
Les patientes traitées par ZEJULA nécessitent une surveillance particulière, et notamment :
- de la NFS : de manière hebdomadaire le premier mois, puis mensuelle pendant 11 mois et ensuite périodique (risque de thrombopénie, anémie, neutropénie) ;
- de la tension artérielle : mensuelle pendant 1 an puis régulière ensuite (risque d'HTA chronique ou aiguë).
ZEJULA et grossesse
Un test de grossesse doit être réalisé chez toutes les femmes en âge de procréer avant le traitement.
Une contraception efficace doit être mise en place pendant le traitement, et jusqu'à 1 mois après la dernière dose.
Identité administrative
- Liste I
- Prescription hospitalière, réservée aux spécialistes en oncologie ou aux médecins compétents en cancérologie
- Surveillance particulière pendant le traitement
- Boîte de 56 gélules, CIP 3400930130858, prix public TTC = 4 755,42 euros
- Boîte de 84 gélules, CIP 3400930126684, prix public TTC = 7 067,98 euros
- Remboursable à 100 % (Journal officiel du 16 mai 2019 - texte 20)
- Agrément aux collectivités (Journal officiel du 16 mai 2019 - texte 21)
- Laboratoire Tesaro Bio France
Pour aller plus loin
Avis de la Commission de la Transparence - ZEJULA (HAS, 13 juin 2018)
Etude pivot
Mirza MR, Monk BJ, Herrstedt , et al. Niraparib Maintenance Therapy in Platinum-Sensitive, Recurrent Ovarian Cancer. N Engl J Med 2016 ; 375 : 2154-64
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 6 minutes
6 minutes Ajouter un commentaire
Ajouter un commentaire







Commentaires
Cliquez ici pour revenir à l'accueil.