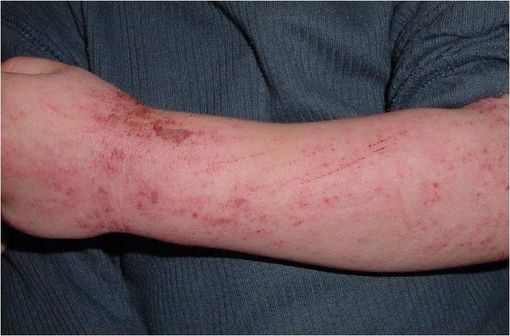
Lésions de dermatite atopique (illustration @Eisfelder sur Wikimedia).
DUPIXENT 300 mg solution injectable en seringue préremplie (dupilumab) est la première biothérapie systémique indiquée dans le traitement de la dermatite atopique modérée à sévère de l'adulte qui nécessite un traitement systémique (Cf. VIDAL Reco "Dermatite atopique de l'adulte").
Son principe actif, le dupilumab est un nouvel anticorps monoclonal recombinant humain de type IgG4 qui inhibe la signalisation de l'interleukine-4 et l'interleukine-13. Ces interleukines sont des cytokines majeures de type 2 (notamment Th2) impliquées dans la dermatite atopique.
Avant d'être commercialisé, le dupilumab a bénéficié d'une autorisation temporaire d'utilisation (ATU) de cohorte de août 2017 à janvier 2018. Depuis janvier 2018, le médicament était disponible en milieu hospitalier, avec une prise en charge en relais d'ATU.
 DUPIXENT fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
DUPIXENT fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.Une efficacité supplémentaire importante par rapport au placebo
Dans son avis du 11 juillet 2018, la Commission de la Transparence a évalué l'efficacité et la tolérance de DUPIXENT sur la base de 5 études de phase III comparatives versus placebo, randomisées en double aveugle. Ces études ont évalué plusieurs schémas d'administration du dupilumab.
L'étude CAFE a comparé le dupilumab (1 injection de 600 mg, puis de 300 mg toutes les 2 semaines) en association à un dermocorticoïde (DC) versus placebo + DC chez 325 adultes atteints de dermatite atopique (DA) sévère en échec ou intolérants à la ciclosporine ou pour lesquels la ciclosporine n'était pas appropriée.
Selon les résultats de cette étude, l'association dupilumab + DC a été supérieure au placebo + DC sur le pourcentage de répondeurs EASI-75 (amélioration du score Eczema Area and Severity Index > ou = à 75 %) à S16 (critère de jugement principal) avec 62,6 % de répondeurs versus 29,6 % (p < 0,0001).
Les résultats de cette étude ont également montré la supériorité du groupe dupilumab + DC par rapport au placebo + DC sur les principaux critères de jugement secondaires, dont la réduction du score NRS (Numerical Rating Scale) de prurit, la réduction du SCORAD (SCORing Atopic Dermatitis), l'amélioration de la qualité de vie (DLQI) et la réduction du score HADS (Hospital Anxiety and Depression Scale) évaluant le niveau d'anxiété et de dépression des patients.
La supériorité du groupe dupilumab sur l'amélioration des scores de sévérité des lésions cutanées, sur la diminution du prurit et sur l'augmentation de la qualité de vie était cliniquement pertinente.
Trois autres études ont été réalisées chez des patients atteints de DA modérée à sévère nécessitant un traitement systémique en échec des traitements topiques, à savoir la population de l'autorisation de mise sur le marché du DUPIXENT : CHRONOS [Lancet Lond Engl 2017 ; 389 : 2287–303 (abstract)], SOLO 1 et SOLO 2 (N Engl J Med 2016 ; 375 : 2335–48) ayant comparé le dupilumab associé (pour CHRONOS) ou non (pour SOLO 1 et 2) aux dermocorticoïdes versus un placebo.
Les résultats de ces études ont montré la supériorité du dupilumab par rapport au placebo avec une différence moyenne du pourcentage de patients atteignant un score IGA (Investigator's Global Assessment) = 0 (patient blanchi : absence de lésions) ou 1 (patient quasiment blanchi) de 28 % et une différence moyenne du pourcentage de répondeurs EASI-75 de 34 % dans les études SOLO 1 et 2 et de 45,7 % dans l'étude CHRONOS.
Les études CHRONOS et SOLO CONTINUE (étude d'extension des études SOLO 1 et 2) ont par ailleurs montré le maintien de la réponse sous dupilumab jusqu'à 52 semaines de traitement.
Selon les analyses post-hoc de ces études, non prévues au protocole, la supériorité du dupilumab par rapport au placebo a été suggérée :
- dans les sous-groupes de patients préalablement traités ou non par immunosuppresseurs systémiques (notamment par ciclosporine),
- dans le sous-groupe des patients pour lesquels la ciclosporine n'était pas appropriée (échec, intolérance, contre-indication ou médicalement déconseillée) ou ayant reçu précédemment du méthotrexate ou de l'azathioprine.
En termes de tolérance, les principaux événements indésirables en lien avec le dupilumab, rapportés dans ces 5 études, ont été des rhinopharyngites, des réactions au site d'injection, des conjonctivites allergiques, des blépharites ainsi que des infections herpétiques et une hyper-éosinophilie transitoire.
Cinq à six pour cent des patients ont présenté des anticorps anti-dupilumab sans qu'il soit observé de différence d'efficacité selon la présence ou non de ces anticorps.
Dans l'ensemble de ces essais, les événements indésirables graves sous dupilumab ont été de l'ordre de 1 à 4 % et moins de 1 % ont nécessité un arrêt de traitement.
SMR important et ASMR modérée en 2e intention après la ciclosporine
Sur la base des données disponibles, la Commission de la Transparence considère que DUPIXENT apporte un service médical rendu (SMR) :
- important dans la stratégie de prise en charge des adultes atteints de dermatite atopique modérée à sévère qui nécessite un traitement systémique, en cas d'échec, d'intolérance ou de contre-indication à la ciclosporine. Dans cette indication, l'amélioration du service médical rendu est jugée modérée (ASMR III) ;
- insuffisant pour justifier une prise en charge par la solidarité nationale chez les adultes atteints de dermatite atopique modérée à sévère en échec des traitements topiques et naïfs de traitements systémiques en l'absence de données comparatives robustes versus ciclosporine par voie orale.
Un plan de gestion des risques (PGR) prévoit la mise en place de mesures de réduction des risques visant à prévenir et/ou à gérer les risques identifiés et potentiels liés à l'utilisation de DUPIXENT ainsi que les informations manquantes.
A ce titre, la Commission note qu'"un risque important d'hypersensibilité systémique (incluant des effets associés d'immunogénicité) a été identifié lors des études évaluant le dupilumab. Le risque de tumeur a été intégré dans le PGR [Plan de Gestion des Risques] comme risque potentiel important sur la base des données de la littérature et des études précliniques considérant l'action pro-tumorigène des IL-4 et 13 via la voie d'activation du récepteur IL-4R alfa".
DUPIXENT en pratique
Le schéma posologique recommandé de DUPIXENT est de :
- 1 dose initiale de 600 mg (2 injections de 300 mg),
- suivie de 300 mg administrés toutes les 2 semaines par injection sous-cutanée.
La seringue préremplie DUPIXENT est prête à l'emploi (Cf. Figure 1). Elle doit être laissée à température ambiante pendant 45 minutes avant l'injection.
Figure 1 - Description de la seringue de DUPIXENT
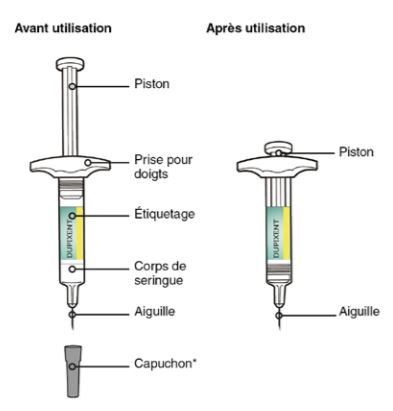 |
* le dispositif peut avoir un capuchon souple ou dur
DUPIXENT s'administre par voie sous-cutanée (SC), dans la cuisse ou l'abdomen (excepté dans la zone de 5 cm autour du nombril). L'auto-injection est envisageable, après accord du médecin et formation du patient.
Une injection dans la partie supérieure du bras est possible si celle-ci est effectuée par une tierce personne.
Pour la dose initiale de 600 mg, il faut administrer successivement 2 injections de DUPIXENT 300 mg dans des sites d'injection différents.
L'association à une corticothérapie locale n'est pas systématique.
Si des inhibiteurs topiques de la calcineurine (tacrolimus) sont prescrits, ils doivent être réservés aux zones sensibles, telles que le visage, le cou, et les zones intertrigineuses ou les parties génitales.
L'arrêt du traitement doit être envisagé chez les patients qui ne présentent aucune réponse après 16 semaines de traitement.
Données de conservation
La seringue préremplie doit être conservée au réfrigérateur, entre 2 et 8 °C.
A température ambiante, le délai de conservation est limité à 14 jours maximum.
Identité administrative
- Liste I
- Prescription initiale hospitalière annuelle
- Prescription initiale et renouvellement réservés aux spécialistes en dermatologie ou en médecine interne
- Boîte de 2 seringues préremplies de 2 mL avec dispositif de protection d'aiguille, munie de 1 aiguille fixe, CIP 3400930116647
- Remboursable à 65 % selon la procédure des médicaments d'exception (Prescription en conformité avec la Fiche d'information thérapeutique publiée au Journal officiel du 8 mars 2019, texte 11)
- Prix public TTC = 1 449,42 euros TTC
- Agrément aux collectivités (Journal officiel du 8 mars 2019, texte 12)
- Laboratoire Sanofi Aventis France
Périmètre de remboursement de DUPIXENT
| Traitement des adultes atteints de dermatite atopique modérée à sévère qui nécessite un traitement systémique en cas d'échec, d'intolérance ou de contre-indication à la ciclosporine. |
Pour aller plus loin
Avis de la Commission de la Transparence - DUPIXENT (HAS, 11 juillet 2018)
Les études pivots
Blauvelt A et al. Long-term management of moderate-to-severe atopic dermatitis with dupilumab and concomitant topical corticosteroids (LIBERTY AD CHRONOS) : a 1-year, randomised, double-blinded, placebo-controlled, phase 3 trial. Lancet Lond Engl 2017 ; 389 : 2287–303 (abstract).
Simpson EL et al. Two Phase 3 Trials of Dupilumab versus Placebo in Atopic Dermatitis. N Engl J Med 2016 ; 375 : 2335–48.
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 6 minutes
6 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.