
Carte d'alerte pour les patients traités par HEMLIBRA.
Premier anticorps monoclonal humanisé bispécifique, HEMLIBRA est indiqué dans le traitement prophylactique des épisodes hémorragiques chez les patients atteints d'hémophilie A congénitale ayant développé un inhibiteur anti-facteur VIII (Cf. VIDAL Reco "Hémophilie").
HEMLIBRA peut être utilisé dans toutes les tranches d'âge.
Son principe actif est une nouvelle substance, l'émicizumab, un agent mimant l'activité du facteur VIII (FVIII).
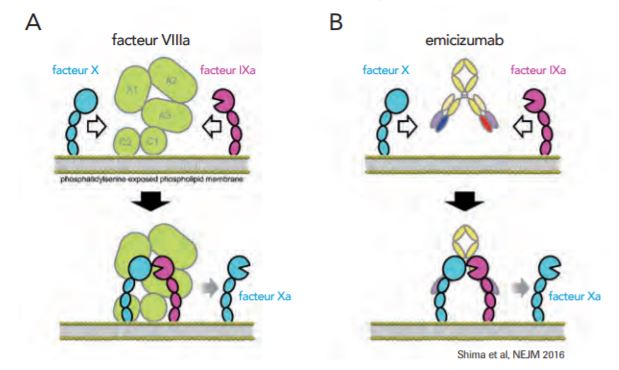
Son mécanisme d'action consiste à imiter la fonction coagulatrice du FVIII en se liant au facteur IXa et au facteur X pour restaurer la fonction du facteur VIIIa nécessaire à une hémostase efficace (Cf. Figure 1).
Figure 1 - Mécanisme d'action de l'émicizumab
(figure extraite du Guide destiné aux professionnels de santé)
N'ayant pas de relation structurelle ni d'homologie de séquence avec le facteur VIII, l'émicizumab n'est pas neutralisé par les inhibiteurs dirigés contre le facteur VIII ; il n'induit pas non plus le développement de tels inhibiteurs.
Du fait de ce mécanisme d'action, la mesure du taux de FVIII ne peut être utilisée pour mesurer l'efficacité biologique du traitement.(figure extraite du Guide destiné aux professionnels de santé)
 |
N'ayant pas de relation structurelle ni d'homologie de séquence avec le facteur VIII, l'émicizumab n'est pas neutralisé par les inhibiteurs dirigés contre le facteur VIII ; il n'induit pas non plus le développement de tels inhibiteurs.
En France, HEMLIBRA a été disponible sous autorisation temporaire d'utilisation (ATU) de cohorte du 12 mars 2018 au 4 juin 2018, dans une indication limitée aux enfants âgés d'au moins 1 an.
 HEMLIBRA fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté.
HEMLIBRA fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté.Une efficacité prophylactique d'HEMLIBRA supérieure aux agents by-passants
Dans son avis du 11 juillet 2018, la Commission de la Transparence (CT) a évalué l'efficacité et la tolérance d'HEMLIBRA sur la base de deux études cliniques de phase III, conduites en prophylaxie au long cours des épisodes hémorragiques chez des patients hémophiles A avec inhibiteurs anti-FVIII, ayant précédemment reçu un traitement à la demande ou prophylactique par agent by-passant :
- HAVEN 1 (N Engl J Med 2017; 377:809-818) randomisée, comparative, en ouvert, ayant inclus 109 adultes et adolescents âgés de 12 à 75 ans : les patients ont reçu une prophylaxie par HEMLIBRA (bras A et C) ou ont été traités à la demande par agent by-passant (BPA : FEIBA ou NOVOSEVEN) dans le bras B (Cf. Figure 2).
Figure 2 - Schéma de l'étude HAVEN 1
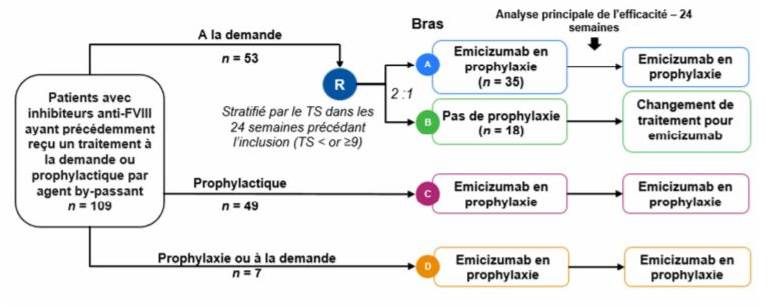 |
L'objectif principal était de comparer le taux annualisé de saignements (TSA) nécessitant un traitement entre le bras A et le bras B, à 24 semaines de traitement.
Les résultats à 24 semaines ont montré un TSA inférieur chez les patients sous prophylaxie par HEMLIBRA (bras A, n = 35) par rapport aux patients traités à la demande par BPA (bras B, n = 18), avec une différence relative de 87 % (Cf. Tableau I). Près de 63 % des patients sous HEMLIBRA (n = 22/35) n'ont pas saigné sur cette période, contre environ 6 % dans le groupe B.
Tableau I - Résultats à 24 semaines en termes de TSA d'après l'étude HAVEN 1
| Bras A Emicizumab en prophylaxie n = 35 |
Bras B Agent « by-passant » à la demande n = 18 |
|
| TSA traités [IC95%] | 2,9 [1,69 ; 5,02] | 23,3 [12,33 ; 43,89] |
| Ratio TSAtraités [IC95%] p | 0,13 [0,057 ; 0,277] p < 0,0001 |
|
- HAVEN 2 (non publiée lors de l'évaluation par la CT) simple bras, en ouvert, conduite chez des enfants de moins de 12 ans, ou âgés de 12 à 17 ans et pesant moins de 40 kg, notamment en attente d'un protocole d'induction de tolérance immune (ITI) [Cf. Figure 3].
Figure 3 - Protocole de l'étude HAVEN 2
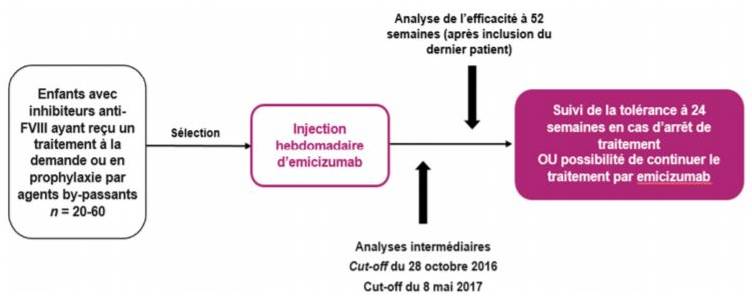 |
L'analyse des taux annualisés de saignements (descriptive) repose sur les données issues des 23 patients âgés de 2 ans à moins de 12 ans traités par l'émicizumab pendant au moins 12 semaines à la même dose (analyse intermédiaire au 8 mai 2017).
La proportion de patients n'ayant présenté aucun saignement traité, soit un TSA < 1, a été de 87,0 % (IC95 % [66,4 ; 97,2], n = 20/23). Trois patients ont rapportés un seul saignement ayant nécessité un traitement (TSA entre 1,3 et 1,4).
Chez les patients issus de l'étude observationnelle, ayant ensuite reçu HEMLIBRA pendant au moins 12 semaines (n = 13), le TSA traité moyen a été de 0,2 [0,06 ; 0,76]. La proportion de patients n'ayant présenté aucun saignement traité a été de 84 % (n= 11/13).
Ces résultats descriptifs suggèrent une diminution de 99 % du TSA sous prophylaxie par HEMLIBRA par rapport au traitement antérieur par BPA, administré en prophylaxie ou à la demande.
Peu de données sont disponibles actuellement chez les patients âgés de moins de 2 ans. Cinq enfant hémophiles sévères de moins de 2 ans (> 1 an) ont été inclus à la date de l'analyse intermédiaire, dont 4 patients traités pendant au moins 12 semaines. Aucun patient n'a présenté de saignement, traité ou non, sur cette période de suivi.
En termes de tolérance, les effets indésirables les plus fréquents au cours des essais cliniques ont été les réactions au site d'injection (19 %), les céphalées (15 %) et les arthralgies (10%).
Les effets indésirables les plus graves ont été :
- les microangiopathie thrombotique (MAT), rapportées chez 1,6 % des patients (n = 3/189) inclus dans l'ensemble des études cliniques ;
- les événements thromboemboliques.
A ce titre, il est recommandé d'utiliser NOVOSEVEN pour traiter les saignements sous HEMLIBRA.
SMR important, ASMR II et traitement de 1re intention en cas d'inhibiteur anti-facteur VIII de type fort répondeur
Sur la base des données disponibles, la Commission de la Transparence estime que le service médical rendu (SMR) d'HEMLIBRA est important dans la population des patients ayant développé un inhibiteur anti-facteur VIII de type fort répondeur ; dans cette indication restreinte, l'amélioration du SMR est également jugée importante (ASMR II) par rapport aux agents by-passants (FEIBA et NOVOSEVEN).
En revanche, faute de données, l'intérêt clinique d'HEMLIBRA est jugé insuffisant en l'absence d'inhibiteur anti-facteur VIII de type fort répondeur.
Un bénéfice important est attendu sur la qualité de vie des patients traités par HEMLIBRA par rapport aux alternatives disponibles.
La CT estime qu'HEMLIBRA doit être considéré comme un traitement de 1re intention pour les patients atteints d'hémophilie A congénitale ayant développé un inhibiteur et de type fort répondeur, pour lesquels une prophylaxie au long cours apparaît comme l'option thérapeutique la mieux adaptée.
HEMLIBRA représente une alternative aux agents by-passants (FEIBA et NOVOSEVEN) dans cette population de patients de type fort répondeur, notamment en cas d'échec de l'ITI (induction de tolérance immune).
HEMLIBRA pourrait également être proposé chez certains patients forts répondeurs en alternative à l'ITI qui représente actuellement le traitement de 1re intention quand un inhibiteur vient d'être diagnostiqué.
Plan de Gestion des Risques
Le plan de gestion des risques (PGR) approuvé par le CHMP (Comité des médicaments à usage humain) européen (version 1.3) mentionne des risques identifiés importants comme les événements thromboemboliques et les microangiopathies thrombotiques, les risques potentiels importants ainsi que des données manquantes (Cf. Tableau II).
Tableau II - Risques identifiés/potentiels importants et données manquantes
concernant HEMLIBRA
concernant HEMLIBRA
| Risques identifiés importants |
|
| Risques potentiels importants |
|
| Informations manquantes |
|
Ce PGR prévoit pour les professionnels de santé susceptibles de prescrire, de dispenser ou d'utiliser HEMLIBRA, pour ceux exerçant dans un laboratoire d'analyse et pour les patients, d'avoir accès à un kit d'éducation comportant :
- pour les médecins :
- pour les patients et les soignants :
- pour les biologistes :
HEMLIBRA en pratique : 1 dose de charge et 1 dose d'entretien
Le traitement par HEMLIBRA doit être instauré sous la surveillance d'un médecin expérimenté dans le traitement de l'hémophilie et/ou des troubles de l'hémostase.
HEMLIBRA est destiné à un traitement prophylactique à long terme.
La posologie recommandée (Cf. Encadré 1) est de :
- 3 mg/kg 1 fois par semaine au cours des 4 premières semaines (dose de charge),
- puis 1,5 mg/kg 1 fois par semaine (dose d'entretien).
Encadré 1 - Calcul de la dose (mg) d'HEMLIBRA
Dose de charge (3 mg/kg) 1 fois par semaine pendant les 4 premières semaines :
|
HEMLIBRA est injectée par voie sous-cutanée. Le volume injecté ne doit pas être supérieur à 2 mL par injection (Cf. Encadré 2).
Encadré 2 - Calcul du volume (mL) d'HEMLIBRA
| Quantité totale (mg) d'émicizumab à administrer ÷ concentration du flacon (mg/mL) = volume total d'HEMLIBRA (mL) à injecter. |
Deux dosages sont proposés :
- 30 mg/mL (flacon de 1 mL),
- 150 mg/mL (flacons de 0,4 mL, 0,7 mL et 1 mL).
Les flacons sont à usage unique.
Modalités d'administration d'HEMLIBRA
L'injection sous-cutanée d'HEMLIBRA doit être réalisée au niveau de l'abdomen, des parties supérieures externes des bras et des cuisses.
Dans la partie supérieure externe du bras, l'injection doit être réalisée par un soignant ou un professionnel de santé.
Après une formation appropriée à la technique d'injection sous-cutanée, un patient pourra s'auto-injecter HEMLIBRA.
L'auto-injection n'est pas recommandée pour les enfants âgés de moins de 7 ans.
Surveillance des paramètres de la coagulation pendant le traitement
L'emicizumab perturbe certains tests de coagulation dont le temps de céphaline activée (TCA) et les tests basés sur le principe du TCA, avec des temps de coagulation très raccourcis sous émicizumab.
Chez les patients traités par HEMLIBRA, les résultats des examens de laboratoire basés sur le principe du TCA ne doivent pas être utilisés pour surveiller l'activité d'emicizumab, ni pour mesurer le taux de FVIII en cas de substitution, ni pour titrer un inhibiteur anti-FVIII.
Les méthodes chromogéniques et immunologiques ne sont pas perturbées et peuvent être utilisées pour surveiller les paramètres de la coagulation pendant le traitement (Cf. Tableau III).
Pour mesurer l'activité du FVIII, il est conseillé d'utiliser une méthode chromogénique utilisant des réactifs d'origine bovine.
Tableau III - Interférences d'HEMLIBRA sur les tests de coagulation
| Tests dont les résultats sont MODIFIÉS par HEMLIBRA | Tests dont les résultats ne sont PAS MODIFIÉS par HEMLIBRA |
|
|
Compte tenu de la demi-vie prolongée d'HEMLIBRA, son interférence sur les examens de coagulation peut persister jusqu'à 6 mois après la dernière dose.
Informations pratiques pour les soignants
Le traitement (incluant la prophylaxie) par des agents by-passants (ex : aPCC et rFVIIa) doit être interrompu la veille de l'instauration du traitement par HEMLIBRA.
Afin d'améliorer la traçabilité des médicaments biologiques, le nom de la spécialité et le numéro de lot du produit administré doivent être clairement inscrits dans le dossier du patient.
Le matériel d'injection à utiliser avec HELIMBRA (pour le prélèvement et l'injection) comprend 1 seringue, 1 aiguille de transfert (ou un adaptateur pour flacon) et 1 aiguille d'injection.
Chaque flacon d'HEMLIBRA est à usage unique.
HEMLIBRA doit être conservé au réfrigérateur entre 2 et 8 °C.
Identité administrative
- Liste I
- Prescription hospitalière
- HEMLIBRA 30 mg/mL, flacon de 1 mL de solution injectable, CIP 3400930141410
- HEMLIBRA 150 mg/mL :
- flacon de 0,4 mL de solution injectable, CIP 3400930141427
- flacon de 0,7 mL de solution injectable, CIP 3400930141434
- flacon 1 mL de solution injectable, CIP 3400930141441
- Agrément aux collectivités (Journal officiel du 6 février 2019 - texte 4)
- Inscription sur la liste T2A (Journal officiel du 6 février 2019 - texte 7)
- Inscription sur la liste de rétrocession avec taux de prise en charge à 100 % (Journal officiel du 6 février 2019 - texte 5)
- Laboratoire Roche
Périmètre de prise en charge
| Prophylaxie des épisodes hémorragiques uniquement chez les patients atteints d'hémophilie A congénitale ayant développé un inhibiteur anti-facteur VIII de type fort répondeur. |
EDIT du 24 mars 2020 : la prise en charge d'HEMLIBRA (agrément aux collectivités, T2A et rétrocession) est étendue en prophylaxie, pour prévenir les épisodes hémorragiques chez les patients atteints d'hémophilie A sévère (déficit congénital en facteur VIII, FVIII inférieur à 1 %) SANS inhibiteur anti-facteur VIII. Cette indication a été octroyée le 11 mars 2019. /FIN EDIT
Pour aller plus loin
Avis de la Commission de la Transparence - HEMLIBRA (HAS, 11 juillet 2018)
Guide destiné aux professionnels de santé
Guide Biologie
HEMLIBRA - Tableau de Correspondance Poids/Dose/Conditionnement
Guide d'administration pas-à-pas destiné aux patients et aux soignants
Guide destiné aux patients et aux soignants
Carte d'alerte Patients
EDIT du 24 mars 2020
Avis de la Commission de la Transparence - HEMLIBRA (HAS, 2 octobre 2019)
Arrêté du 11 mars 2020 relatif aux conditions de prise en charge de HEMLIBRA sur la liste de rétrocession (Journal officiel du 18 mars 2020 - texte 13)
Arrêté du 11 mars 2020 modifiant la liste des spécialités agréées aux collectivités - HEMLIBRA (Journal officiel du 18 mars 2020 - texte 14)
Arrêté du 11 mars 2020 modifiant la liste des spécialités prises en charge en sus de la T2A - HEMLIBRA (Journal officiel du 18 mars 2020 - texte 14)
/FIN EDIT
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 10 minutes
10 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.