
Maladie hémorragique non héréditaire rare, l'hémophilie acquise affecte principalement les personnes âgées (plus de 60 ans dans 2/3 des cas environ), quel que soit leur sexe (illustration).
OBIZUR 500 U poudre et solvant pour solution injectable (susoctocog alfa) est un nouveau facteur VIII recombinant indiqué dans le traitement des épisodes hémorragiques chez les patients adultes atteints d'hémophilie acquise due aux anticorps contre le facteur VIII.
Le principe actif d'OBIZUR est le susoctocog alfa ; il s'agit d'un nouveau facteur VIII recombinant de séquence porcine (produit sur cellules de reins de hamster BHK) dépourvu du domaine B.
Son mécanisme d'action repose sur sa forte homologie structurelle avec le FVIII humain et sa moindre sensibilité à l'inactivation par les auto-anticorps anti-FVIII humain : de ce fait, OBIZUR présente peu de réactivité croisée avec l'inhibiteur anti-FVIII d'origine humaine et est susceptible de rétablir l'hémostase en remplaçant le facteur VIII inhibé.
 OBIZUR fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
OBIZUR fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.Une étude de série de cas sur 28 patients
La demande de prise en charge d'OBIZUR a été étudiée en 2016 par la Commission de la Transparence (Cf. Avis du 30 novembre 2016).
Dans ce document, les membres de la Commission rappellent d'emblée que "l'AMM d'OBIZUR a été octroyée « sous circonstances exceptionnelles » en raison du peu de données cliniques disponibles lié à la rareté de la maladie".
L'Agence européenne du médicament (EMA) a demandé la mise en place d'un registre de patients et d'une étude prospective en vie réelle.
Le laboratoire a fourni un étude multicentrique de phase II/III (étude 301/301a), prospective, en ouvert, non randomisée, en cohorte unique de faible effectif (n = 29 patients inclus).
Le but de cette étude était d'évaluer l'efficacité et la tolérance d'OBIZUR chez des patients adultes atteints d'hémophilie acquise présentant des hémorragies graves.
Le critère de jugement principal était la proportion d'épisodes hémorragiques graves répondant au traitement par OBIZUR dans les 24 heures après la 1re administration.
Une réponse positive était définie comme un contrôle efficace ou partiellement efficace de l'hémorragie (Cf. Tableau I).
Tableau I - Echelle d'évaluation de la réponse au traitement par OBIZUR
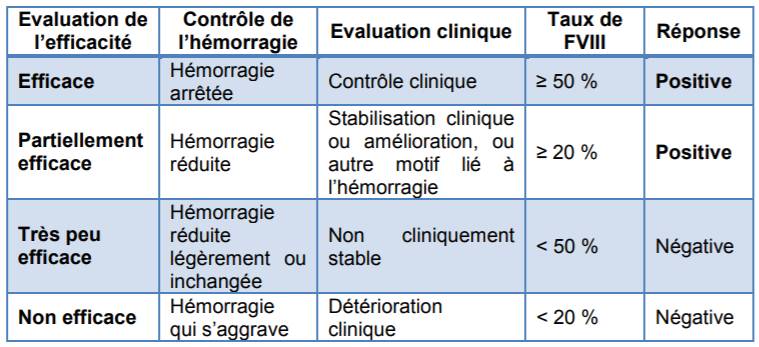
Selon les résultats de cette étude, tous les patients (population ITT, n = 28) ont eu une réponse positive au traitement par OBIZUR 24 heures après l'administration initiale d'OBIZUR.
Pour 86 % des patients, l'épisode hémorragique initial a été contrôlé (résolu).
Selon l'analyse statistique prédéfinie, l'hypothèse d'un taux de réponse positive à OBIZUR supérieur à 50 % (p < 0,001) a été acceptée.
Aucun patient n'a été considéré comme non répondeur au traitement par OBIZUR (réponse faiblement efficace ou non efficace) 24 heures après l'administration de la dose initiale.
Les doses d'OBIZUR et des fréquences d'administration (critères de jugement secondaires) ont été très variables d'un patient à l'autre. Une dose médiane de 1637 U/kg d'OBIZUR (150 à 12 194 U/kg) et de 13 (1-57) injections ont été nécessaires sur une durée médiane de 6 jours pour le contrôle de l'hémorragie.
Concernant le développement d'anticorps anti-FVIII porcin, 25 % des patients (n = 5) qui n'en avaient pas à l'inclusion en ont développé pendant l'exposition à OBIZUR. Les données disponibles ne permettent pas d'évaluer le risque de résistance à un traitement ultérieur lié à la présence d'anticorps anti-FVIII porcin.
En termes de tolérance, les événements indésirables les plus fréquemment rapportés ont été la constipation (12 patients, 41,4 %), la diarrhée (7 patients, 24,1 %), l'hypokaliémie (7 patients, 24,1 %), l'anémie (6 patients, 20,7 %) et l'œdème périphérique (6 patients, 20,7 %).
Treize patients (44,8 %) ont rapporté un total de 33 événements indésirables graves au cours de l'étude. Pour 7 patients, ces événements indésirables ont conduit au décès, principalement en raison d'un événement hémorragique ou infectieux : aucun n'a été considéré par les investigateurs comme lié à OBIZUR. Les plus fréquemment rapportés ont été pneumonie (n = 3, 10,3 %), sepsis (n = 2, 6,9 %) et hémorragie intracrânienne (n = 2, 6,9 %). Tous ont été considérés comme non liés (n = 28) ou probablement non liés (n = 5) à OBIZUR.
OBIZUR fait l'objet d'un plan de gestion des risques visant à évaluer les risques identifiés, les risques potentiels et les informations manquantes (Cf. Tableau II).
Tableau II - Risques identifiés, potentiels et informations manquantes visées dans le PGR
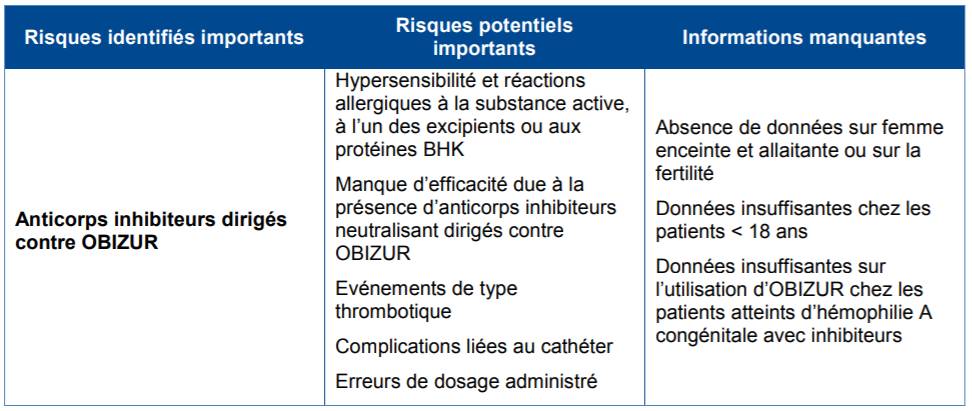
La Commission de la Transparence regrette l'absence de comparaison à FEIBA (facteurs de coagulation court-circuitant l'inhibiteur du facteur VIII) ou NOVOSEVEN (eptacog alfa activé), les deux comparateurs cliniquement pertinents d'OBIZUR, utilisés pour traiter les épisodes hémorragiques chez les patients atteints d'hémophilie acquise.
Elle rappelle que, contrairement à FEIBA et NOVOSEVEN, OBIZUR n'a pas l'autorisation de mise sur le marché (AMM) en prophylaxie des saignements avant une intervention chirurgicale, ni en cas d'hémophilie A congénitale avec inhibiteurs.
Traitement de 1re intention, SMR important, pas d'ASMR
En conclusion de son avis, la Commission de la Transparence considère qu'OBIZUR est un "traitement de première intention des épisodes hémorragiques graves chez les patients atteints d'hémophilie acquise. En présence d'un titre élevé d'anticorps anti-FVIII porcin, le recours à un agent by-passant (FEIBA ou NOVOSEVEN) plutôt qu'à OBIZUR devrait être envisagé".
La Commission attribue à OBIZUR un service médical rendu (SMR) important sans amélioration du SMR (ASMR V) dans la stratégie actuelle de prise en charge des hémorragies graves chez les patients atteints d'hémophilie acquise, compte tenu :
- "de l'efficacité d'OBIZUR pour contrôler les hémorragies dans une étude de série de cas sur 28 patients,
- de la possibilité d'un suivi biologique fondé sur la mesure de l'activité du FVIII,
- mais des incertitudes sur le risque de développer des anticorps anti-FVIII porcin sous OBIZUR et leur impact sur la réponse à un traitement ultérieur,
- des données cliniques encore limitées, notamment du profil de tolérance peu documenté".
OBIZUR en pratique
OBIZUR est réservé à l'usage hospitalier, sous la responsabilité d'un médecin expérimenté dans la prise en charge de l'hémophilie.
Le produit ne peut être administré qu'à des patients hospitalisés. Une supervision clinique de l'état hémorragique du patient doit être mise en place :
- surveillance de l'activité du facteur VIII, juste avant chaque dose ultérieure et 30 minutes après,
- surveillance de l'état clinique du patient 30 minutes après la première injection et 3 heures après l'administration d'OBIZUR.
- Posologie : les paramètres à prendre en compte
Chaque flacon de poudre contient une quantité nominale de 500 unités de susoctocog alfa.
Le nombre de flacon requis pour la dose initiale est obtenu à partir de la formule suivante :
| Dose initiale (U/kg) ÷ dosage du produit (U/flacon) x poids corporel (kg) = nombre de flacons |
La posologie, la fréquence et la durée du traitement par OBIZUR sont établies en fonction du site, de l'étendue et de la sévérité de l'épisode hémorragique, de l'activité cible du facteur VIII et de l'état clinique du patient.
Le nombre d'unités de facteur VIII à administrer est indiqué en unités (U), dérivées d'un standard interne qui a été calibré selon le standard actuel de l'OMS pour les facteurs VIII.
Une unité (U) d'activité du facteur VIII est équivalente à la quantité de facteur VIII présente dans 1 mL de plasma humain normal.
- Modalités d'injection
Le volume total d'OBIZUR reconstitué doit être administré à une vitesse de 1 à 2 mL par minute.
Avant reconstitution, OBIZUR se conserve au réfrigérateur (entre 2 °C et 8 °C).
La solution reconstituée doit être utilisée immédiatement, au maximum 3 heures après la reconstitution.
Il est fortement recommandé, à chaque administration d'OBIZUR à un patient, d'enregistrer le nom et le numéro de lot du médicament afin de maintenir un lien entre le patient et le lot de médicament.
Identité administrative
- Liste I
- Réservé à l'usage hospitalier
- Boîte de 1 flacon de poudre + 1 seringue de 5 mL, CIP 3400955016557, UCD 3400894152866
- Agrément aux collectivités (Journal officiel du 20 juin 2018, texte 14)
- Inscrit sur la liste des spécialités prises en charges en sus des GHS (Journal officiel du 20 juin 2018, texte 17)
- Laboratoire Shire France
Pour aller plus loin
Avis de la Commission de la Transparence - OBIZUR (HAS, 30 novembre 2016)
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 6 minutes
6 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.