L'association irbésartan - hydrochlorothiazide est indiquée chez les patients présentant une hypertension artérielle insuffisamment contrôlée par l'irbésartan seul ou l'hydrochlorothiazide seul (illustration).
Rappel de 8 lots de génériques Arrow contenant de l'irbésartan
Le laboratoire Arrow a rappelé auprès des pharmacies de ville, d'hôpital, et des circuits de distribution pharmaceutique, les lots de spécialités suivantes d'irbésartan, suite à la détection de l'impureté NDEA (N-nitrosodiéthylamine) à des taux supérieurs aux limites acceptables :
IRBESARTAN/HYDROCHLOROTHIAZIDE ARROW GENERIQUES 300 mg/12,5 mg comprimé pelliculé, boîte de 90
Lot 059118 - 31/03/2020
Lot 099218 - 31/03/2020
IRBESARTAN/HYDROCHLOROTHIAZIDE ARROW GENERIQUES 300 mg/25 mg comprimé pelliculé, boîte de 90
Lot 058718 - 29/02/2020
Lot 015518 - 29/02/2020
IRBESARTAN/HYDROCHLOROTHIAZIDE ARROW GENERIQUES 300 mg/12,5 mg comprimé pelliculé, boîte de 30
Lot 058718 - 28/02/2020
IRBESARTAN/HYDROCHLOROTHIAZIDE ARROW GENERIQUES 150 mg/12,5 mg comprimé pelliculé, boîte de 30
Lot 058818 - 29/02/2020
Lot 150118 - 30/04/2020
IRBESARTAN/HYDROCHLOROTHIAZIDE ARROW GENERIQUES 150 mg/12,5 mg comprimé pelliculé, boîte de 90
Lot 058918 - 29/02/2020
Après le valsartan, l'irbésartan
Les investigations déclenchées au cours de l'été 2018 par le défaut de qualité des spécialités de valsartan (voir notre article du 12/7/2018) ont rapidement été élargies à l'ensemble des sartans : irbésartan, candésartan, losartan et olmésartan.
En effet, ces substances sont fabriquées selon un procédé similaire à celui du valsartan, avec le risque de présenter le même défaut à savoir la présence des impuretés NDMA (N-nitrosodiméthylamine) et NDEA (N-nitrosodiéthylamine).
Ces contrôles ont permis de révéler la présence de NDEA dans des spécialités d'irbésartan du laboratoire Arrow. Il s'agit du premier rappel de lots réalisé en France pour ce motif sur une spécialité de sartan autre que le valsartan.
Dans un point d'information publié vendredi 11 janvier, l'ANSM (Agence nationale de sécurité du médicament et des produits de santé) n'exclut pas que "d'autres sartans puissent faire l'objet de prochains rappels de lots", au fur et à mesure des résultats de contrôles en cours.
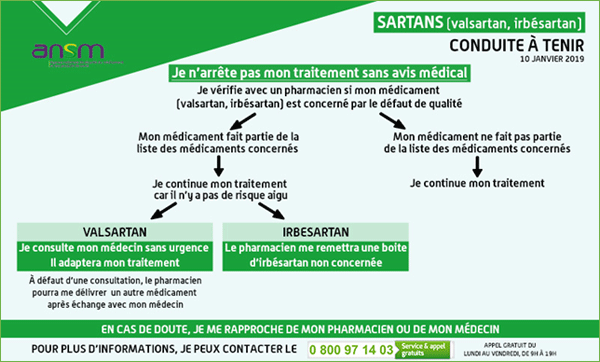
En pratique, l'ANSM recommande avant tout de rappeler aux patients de ne pas arrêter leur traitement en cours.
Comme lors des rappels de lots des spécialités de valsartan, l'ANSM rappelle :
- que la présence de NDMA et NDEA n'induit pas de risque aigu pour la santé des patients, bien que ces substances soient classées cancérogènes probables pour l'homme par l'OMS (Organisation mondiale de la santé) ;
- qu'un traitement en cours par sartan ne doit pas être interrompu brutalement, au risque d'exposer le patient à des troubles cardiaques ou neurologiques graves (poussées hypertensives, décompensations cardiaques, accidents neurologiques...).
D'autres spécialités d'irbésartan sont disponibles sur le marché français.
Suite à ce rappel de lots d'IRBESARTAN ARROW, il est recommandé :
- aux patients de vérifier, avec le pharmacien, si le médicament d'irbésartan qu'ils prennent est concerné par le rappel de lots,
- au pharmacien de remettre au patient une boîte d'irbésartan non concernée par l'alerte.
Mesures prises par l'ANSM et l'EMA
La présence potentielle de NDEA et NDMA dans les spécialités de sartans est liée au procédé de fabrication du principe actif.
Depuis le 1er janvier 2019, les autorités européennes demandent un contrôle en amont de la fabrication des médicaments à base de sartan, c'est-à-dire sur les matières premières directement. Ceci doit permettre d'éviter une mise en production et une libération des spécialités présentant cette anomalie.
De son côté, l'ANSM a mis à jour :
- la liste des spécialités de valsartan et d'irbésartan concernées par le rappel de lots (10 janvier 2019),
- la liste des spécialités de valsartan et d'autres sartans non concernées par le rappel de lots (10 janvier 2019),
- la disponibilité des spécialités de valsartan et autres sartans au 10 janvier 2019.
L'Agence française a demandé aux laboratoires commercialisant des médicaments à base de sartan non concernés par le défaut de qualité ou d'autres alternatives d'intensifier leur production, afin de limiter l'impact en termes d'approvisionnement. Selon l'ANSM, des laboratoires ont déjà mis en oeuvre cette demande.
Enfin, le numéro vert (0 800 97 14 03) reste ouvert pour répondre aux questions des professionnels de santé et des patients.
Pour aller plus loin
Irbesartan/hydrochlorothiazide arrow génériques 150 mg/12,5 mg, 300 mg/12,5 mg et 300 mg/25 mg, comprimé pelliculé - Arrow génériques - Rappel de lots (ANSM, 11 janvier 2019)
Rappel de lots de médicaments à base d'irbésartan - Point d'Information (ANSM, 11 janvier 2019)
Liste des médicaments concernés (ANSM, 11 janvier 2019)
Liste des médicaments non concernés (ANSM, 11 janvier 2019)
Disponibilité des médicaments à base de valsartan et autres sartans en France (ANSM, 10 janvier 2019)
Sur VIDAL.fr
Valsartan : nouveau rappel de lots, recommandations aux professionnels de santé et au grand public (3 décembre 2018, mis à jour le 27 décembre 2018)
Spécialités de valsartan : les recommandations de l'ANSM pour préserver les stocks restants 5 septembre 2018)
Spécialités de valsartan et de valsartan/hydrochlorothiazide : important rappel de lots et recommandations de l'ANSM (12 juillet 2018)

 4 minutes
4 minutes Ajouter un commentaire
Ajouter un commentaire.jpg)





Commentaires
Cliquez ici pour revenir à l'accueil.