Arbre décisionnel pour l'hyperéosinophilie (complet et plus lisible ci-dessous), adapté de M Van Balkum et al., décembre 2018.
L'hyperéosinophilie peut être légère, modérée ou sévère
La mesure du nombre de polynucléaires éosinophiles, globules blancs fabriqués par la moelle osseuse, permet de détecter une hyperéosinophilie (Valent P et al. J. Allergy Clin Immunol., 2012 2) :
- Eosinophilie normale : 4 à 600 éosinophiles / mm3 de sang (0,04 à 0,6 x109 / l).
- Hyperéosinophilie légère : 500 à 1 500 / mm3 (0,5 à 1,5 x109 / l).
- Hyperéosinophilie modérée : 1 500 à 5 000 / mm3 (1,5 à 5 x 109 / l).
- Hyperéosinophilie sévère : plus de 5 000 / mm3 (> 5 x 109 / l).
En cas d'hyperéosinophilie détectée, il est recommandé de refaire cette mesure au moins 1 mois après, pour la confirmer ou l'infirmer.
Une hyperéosinophilie peut également être identifiée :
- sur une biopsie de moelle osseuse (au moins 20 % d'éosinophiles),
- et / ou sur une infiltration éosinophile d'une biopsie tissulaire (un tissu sain ne contient pas d'éosinophiles) ;
- et / ou en cas de dépôts extracellulaires de protéines cationiques de l'éosinophile.
Si une hyperéosinophilie modérée à sévère (> 1 500 / mm3) persiste pendant plus de 6 mois sans cause identifiée, on parle de syndrome hyperéosinophilique, pouvant entraîner des lésions organiques directement induites par les éosinophiles.
Les causes possibles d'hyperéosinophilie
Si les allergies, les réactions médicamenteuses et les parasitoses sont les causes les plus fréquentes d'hyperéosinophilie, de nombreuses conditions pathologiques peuvent y conduire.
En l'absence de cause évidente "réactionnelle" (iatrogénie, allergie, réaction à un parasite dans un contexte de voyage), il convient donc de rechercher une cause auto-immune ou tumorale, solide (cancer du poumon par exemple) ou liquide (lymphomes, leucémies, cf. infra).
Il est également possible qu'aucune cause ne soit retrouvée ("hyperéosinophilie d'origine inconnue").
Voici un tableau récapitulatif proposé par M van Balkum et al. dans The Netherlands Journal of Medicine 1, adapté de Valent P et al. World Allergy Organ J. 2012 3 :
Hyperéosinophilie et syndrome hyperéosinophilique réactionnels ou secondaires :
- Infections parasitaires (les plus fréquentes étant les ankylostomes, les infections à ascaris et à filaires, suivies de la bilharziose et de l'anguillulose.
- Allergie, atopie, aspergillose bronchopulmonaire allergique.
- Effet secondaire d'un médicament (antibiotiques, antipaludéens, sulfamides, antiépileptiques, allopurinol, IEC, AINS, IPP, vitamines, compléments alimentaires, etc.).
- Maladies auto-immunes (périartérite noueuse, fasciite à éosinophiles, dermatomyosite, lupus érythémateux disséminé, Maladie de Crohn, rectocolite hémorragique, pemphigus, psoriasis, etc.).
- Lymphomes malins : Hodgkin, leucémie aiguë lymphoblastique à cellules T, lymphome T non Hodgkinien.
- Mastocytose systémique.
- Tumeurs solides (estomac, œsophage, poumon).
- Maladie du greffon contre l'hôte.
- Tumeurs malignes myéloïdes : syndromes myéloprolifératifs (leucémie myéloïde chronique, maladie de Vaquez), mastocytose systémique, syndrome myélodysplasiques avec hyperéosinophilie, leucémie aiguë myéloïde avec formation des gènes de fusion CBFB-MYH11 (CBFb).
- Tumeurs malignes myéloïdes et des cellules souches hématopoïétiques avec réarrangements génétiques : gènes codant pour les récepteurs A et B des facteurs de croissance plaquettaire (PDGFRA et PDGFRB), gène du récepteur du facteur de croissance fibroblastique de type 1 (FGFR1), fusion des gènes PCM1-JAK2, fusion des gènes FIP1L1- PDGFRA.
- Syndrome de Gleich.
- Syndrome de Churg-Strauss.
- Syndrome d'Omenn.
- Syndrome éosinophilie–myalgie.
- Syndrome Hyper IgE.
- Hyperéosinophilie héréditaire (ne pouvant pas être spécifiée autrement).
- Hyperéosinophilie idiopathique, sans lésion organique liée aux éosinophiles.
Des points d'appel cliniques sont possibles et peuvent orienter le diagnostic
Divers symptômes peuvent accompagner une hyperéosinophilie ou un syndrome hyperéosinophilique : fatigue (26 %), toux (24 %), dyspnée (16 %), douleurs musculaires et angiodèmes (14 %), éruption cutanée ou fièvre (12 %), rhinite (10 %).
Les auteurs soulignent que des déficits neurologiques ont déjà été décrits, en particulier une faiblesse musculaire et une polyneuropathie.
Une fibrose endomyocardique (associée à un risque d'insuffisance cardiaque) et des thromboses peuvent aussi survenir.
Tenir compte du contexte et des causes possibles pour établir le diagnostic
Toute la difficulté, au vu de toutes ces causes possibles et en l'absence de cause évidente, est de poser le diagnostic.
Un diagnostic allergique, atopique est souvent facile à poser au vu de l'histoire clinique et des signes physiques. Il peut être confirmé par la mesure des IgE sériques ou des tests allergologiques plus spécifiques.
Lorsqu'une origine médicamenteuse est recherchée, il est important d'interroger le patient sur ses médicaments prescrits mais aussi sur ceux qu'il prend éventuellement en automédication, ainsi que d'éventuels compléments alimentaires, vitamines, etc. Les auteurs citent le cas d'une épidémie de syndromes myalgiques à éosinophiles en Amérique Latine lié à la consommation de L-tryptophane (Ned Tijdschr Geneeskd. 1990 4).
L'interrogatoire doit aussi porter sur les voyages de la personne concernée. Le cas échéant, une recherche de parasites dans les selles peut être demandée, en gardant en mémoire que les œufs ne sont pas tout de suite détectés dans les selles et qu'il faut attendre plusieurs semaines. Donc ne pas hésiter à répéter l'examen parasitologique des selles, surtout en l'absence de cause identifiée entretemps.
La biopsie de la moelle osseuse est indiquée chez tout patient présentant une hyperéosinophilie inexpliquée et persistante. Il faudra demander un examen cytologique, une immunohistochimie, une analyse cytogénétique, une hybridation in situ en fluorescence (FISH) et une analyse moléculaire. Le dépistage de réarrangements de PDGFRA, PDGFRB et FGFR1 est essentiel. L'identification du gène de fusion FIP1L1-PDGFRA doit être effectuée avec FISH ou une réaction en chaîne par polymérase par transcription inverse (RT-PCR).
En cas d'hyperéosinophilie persistante, il faut rechercher un syndrome hyperéosinophilique et d'éventuelles défaillances secondaires d'organes. Des consultations spécialisées avec un cardiologue (recherche d'une fibrose endomyocardique ou d'une thrombose), un dermatologue (biopsies cutanées) et un neurologue (recherche d'un déficit neurologique) sont donc conseillées.
Arbre décisionnel récapitulatif
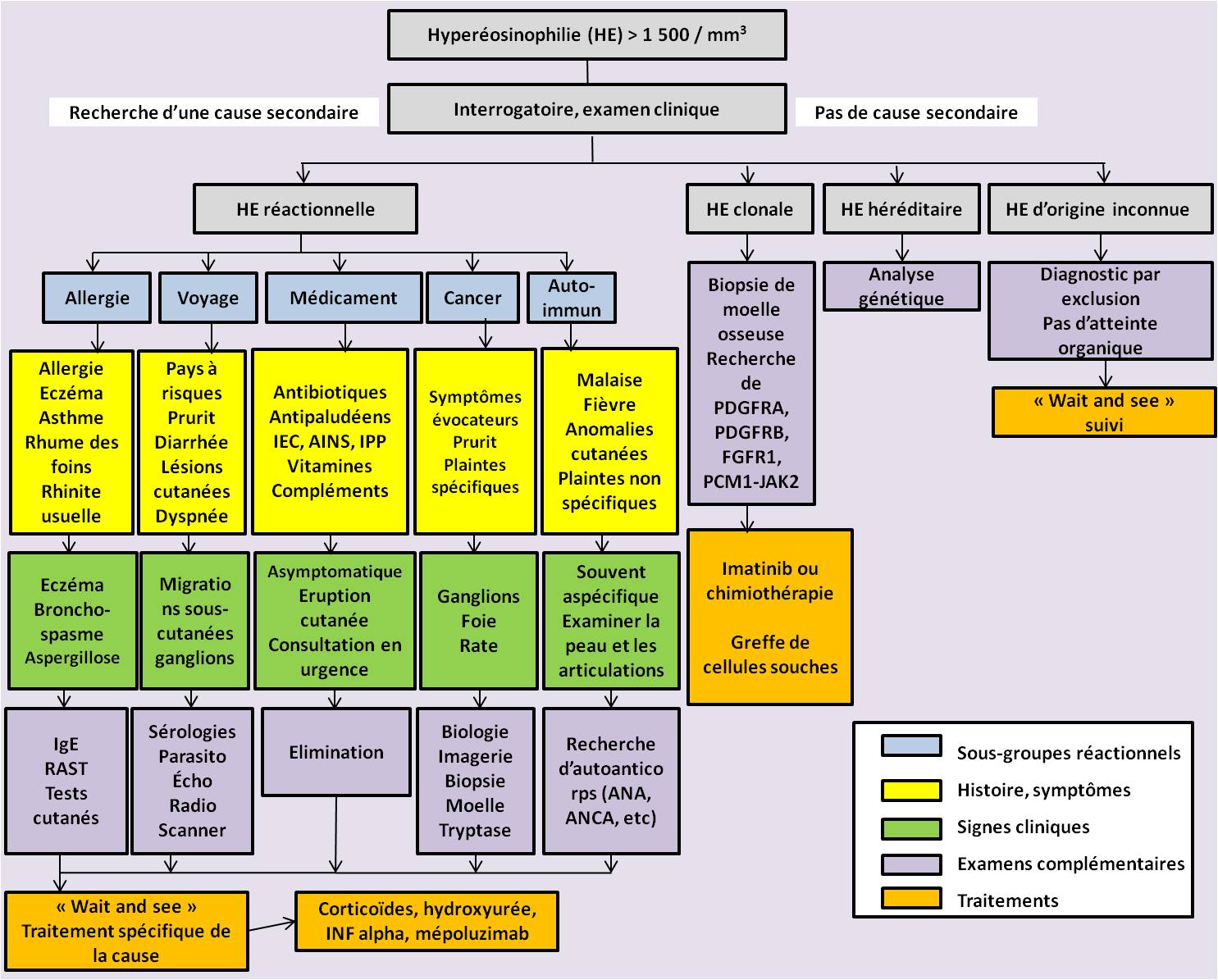
Traitement et suivi : en fonction de la cause
En cas de cause médicamenteuse ou allergique, le traitement repose bien sûr sur l'éviction de la cause.
Si une cause parasitaire est identifiée, la molécule est à choisir en fonction du parasite et du degré d'urgence. Par exemple, en cas d'anguillulose (due à un petit ver rond, le Strongyloides stercoralis, ou anguillule, pouvant se manifester par des douleurs abdominales violentes, crises diarrhéiques intenses, etc.), un risque d'évolution vers une "hyperinfection". L'ivermectine peut donc alors être débutée de manière empirique (en attendant les résultats de la sérologie) à raison de 0,22 mg / kg.
Plus généralement, en cas d'hyperéosinophilie modérée sans signes d'atteinte organique secondaire, une politique d'attentisme peut être justifiée.
En cas de lésions organiques liées à l'hyperéosinophilie (syndrome hyperéosinophilique), une corticothérapie systématique peut être mise en place (0,5 à 1 mg / kg), "très efficace pour réduire rapidement le nombre d'éosinophiles". En cas d'intolérance aux corticoïdes ou d'effets secondaires, de l'hydroxyurée (ou hydroxycarbamide) ou de l'interféron alpha peuvent être utilisés.
Le mépolizumab, indiqué dans l'asthme sévère réfractaire à éosinophiles, peut aussi être exceptionnellement utilisé en cas de syndrome hyperéosinophilique sévère menaçant le pronostic vital après échec des autres traitements.
En cas de tumeur maligne solide ou liquide évoquée ci-dessus, le traitement sera mis en œuvre par les centres experts.
Lorsqu'un gène de fusion PDGFRA ou PDGFRB est identifié, un traitement par imatinib peut être mis en œuvre, à 100 mg par jour. L'instauration doit être rapide afin d'éviter la constitution de complications irréversibles, comme la fibrose endomyocardique. Les patients porteurs d'une mutation de FGRF1 résistent souvent à l'imatinib (réponse de 14 à 60 % seulement), imposant alors le plus souvent le recours à une chimiothérapie intensive suivie d'une greffe allogénique de cellules souches.
En conclusion : ne pas hésiter à faire un examen de la moelle osseuse en cas de doute
Les auteurs rappellent que l'hyperéosinophilie est souvent liée à une cause facilement identifiable. Mais des explorations plus approfondies sont parfois nécessaires.
Lorsque le diagnostic reste flou, la perception d'un risque d'hémopathie maligne doit faire effectuer une analyse de la moelle osseuse.
Enfin, en cas d'hyperéosinophilie persistante, il faut penser au risque d'une évolution vers un syndrome hyperéosinophilique, à traiter avant la survenue de complications organiques.
En savoir plus :
- Hypereosinophilia: a diagnostic challenge, M. van Balkum, H. Kluin-Nelemans, J.J. van Hellemond, P.J.J. van Genderen, P.J. Wismans, The NetherlandsJournal of Medicine, décembre 2018
- Contemporary consensus proposal on criteria and classification of eosinophilic disorders and related syndromes. Valent P, Klion AD, Horny HP, et al. J. Allergy Clin Immunol. 2012;130:607-12
- ICON: Eosinophil Disorders. Valent P, Klion AD, Rosenwasser LJ, et al. World Allergy Organ J. 2012;5:174-81.
- L-tryptofaan en het eosinofilie-myalgie-syndroom. De Smet PAGM, Stricker BHCh. Ned Tijdschr Geneeskd. 1990;134:1123-5.
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 6 minutes
6 minutes 4 commentaires
4 commentaires 


Commentaires
Cliquez ici pour revenir à l'accueil.