KALETRA solution buvable est indiqué en association avec d’autres médicaments antirétroviraux pour le traitement des adultes, des adolescents et des enfants âgés de 14 jours et plus, infectés par le VIH-1 (illustration).
Nouvelle présentation de KALETRA solution buvable
KALETRA (80 mg + 20 mg)/mL solution buvable en flacon de 60 mL [Cf. Encadré 1] est désormais disponible sous une nouvelle présentation comportant 2 seringues pour administration orale de 2 mL avec graduations de 0,1 mL, adaptées à la population pédiatrique nécessitant la prise d'un volume inférieur à 2 mL.
Encadré 1 - Indications thérapeutiques de KALETRA
|
Cette nouvelle présentation de KALETRA solution buvable s'ajoute à celle commercialisée depuis 2001, en boîte de 5 flacons de 60 mL avec 5 seringues de 5 mL.
La formulation en principe actif reste inchangée, à savoir :
- 80 mg de lopinavir (inhibiteur des protéases du VIH-1 et du VIH-2) pour 1 mL de solution buvable,
- 20 mg de ritonavir (potentialisateur pharmacocinétique du lopinavir) pour 1 mL de solution buvable.
KALETRA chez les enfants
KALETRA est le seul antirétroviral de la classe des inhibiteurs de protéase indiqué chez les nourrissons et jeunes enfants de moins de 24 mois infectés par le VIH-1.
En effet, dans le cadre du programme d'investigation pédiatrique (PIP) validé en 2011, l'autorisation de mise sur le marché (AMM) de KALETRA en pédiatrie a été étendue aux nourrissons et jeunes enfants âgés de 14 jours à 2 ans sur la base des études cliniques suivantes :
- l'étude P1030 de phase I/II multicentrique, de recherche de dose chez les enfants de moins de 6 mois ;
- l'étude P1060 de phase II, multicentrique, contrôlée versus névirapine, randomisée, comparant le taux d'échec chez des enfants de 2 à 36 mois, selon l'exposition préalable à la névirapine durant la grossesse pour prévenir la transmission mère-enfant,
- l'étude CHER de phase III, ouverte, comparant 3 stratégies de traitement (un traitement différé, un traitement immédiat pendant 40 semaines ou un traitement immédiat pendant 96 semaines) chez des nourrissons âgés de 6 à 12 semaines présentant une infection périnatale par VIH-1.
Selon les résultats de ces études, la réponse immuno-virologique observée apparaît globalement du même ordre que celle décrite dans les autres cohortes de patients plus âgés, avec un profil de tolérance similaire.
Dans l'étude clinique de phase II (étude P1060), les échecs virologiques ont été moins fréquents avec le lopinavir/ritonavir qu'avec la névirapine (20 % contre 40 %), avec un profil de tolérance comparable.
Ces résultats confortent le lopinavir/ritonavir comme choix préférentiel de première ligne dans cette tranche d'âge (14 jours à 2 ans), indépendamment de l'exposition préalable à la névirapine durant la grossesse pour prévenir la transmission mère-enfant.
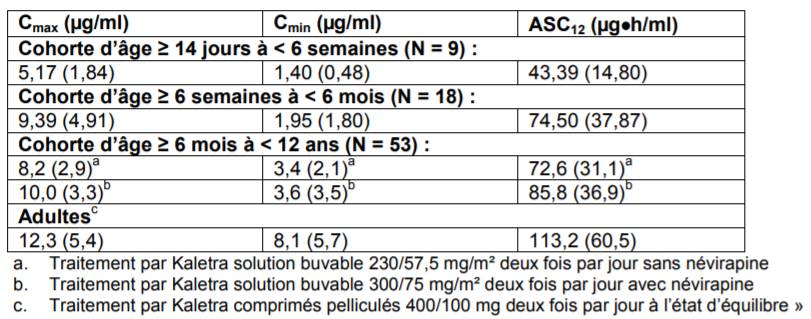
Néanmoins, chez les jeunes enfants de 14 jours à 3 mois, les données pharmacocinétiques (étude 1030) indiquent une exposition sous-optimale (inférieure à celle des adultes d'environ 35 % pour l'ASC12 et 75 % pour la Cmin), avec un risque potentiel de suppression virologique inadéquate et l'émergence de résistances (Cf. Tableau I).
Tableau I - Données pharmacocinétique de KALETRA selon l'étude P1030
SMR important chez les enfants de 14 jours à 2 ans
Sur la base des données disponibles, la Commission de la transparence a estimé, dans son avis du 21 février 2018, que KALETRA solution buvable apporte un service médical rendu important dans l'extension d'indication aux enfants âgés de 14 jours à 2 ans, en raison notamment "de son importante efficacité immuno-virologique, de sa barrière génétique à la résistance élevée, de son profil de tolérance favorable, et de sa coformulation en solution buvable adaptée aux enfants en bas âge".
La Commission considère que cette nouvelle présentation est un complément de gamme qui n'apporte pas d'amélioration du SMR (ASMR V) par rapport aux autres présentations de KALETRA actuellement disponibles.
Dans la stratégie thérapeutique (Cf. Tableau II) chez l'enfant de 14 jours à 2 ans, la Commission place KALETRA comme étant le choix préférentiel de l'IP/r (inhibiteur de protéase boosté par le ritonavir). Le lopinavir/ritonavir doit être administré en association à d'autres médicaments antirétroviraux. Son utilisation doit être guidée par un test de résistance génotypique.
La Commission attire l'attention sur le fait que le lopinavir/ritonavir est contre-indiqué chez les enfants de moins de 14 jours, en raison du risque particulier de toxicité dû aux quantités d'alcool et de propylène glycol contenues dans KALETRA.
Tableau II - Choix du traitement initial chez l'enfant selon le rapport d'expert de 2013, actualisé en février 2018 - Recommandations (en l'absence de co-intection à l'hépatite B ou de tuberculose) du groupe d'expert pour la prise en charge du VIH sous la direction du Professeur Philippe Morlat
| Âge | < 3 ans | 3 – 6 ans | 6 – 12 ans | > ou = 12 ans | |
| Traitement préférentiel | Association d'INTI | ABC + 3TC (ou FTC) | ABC*+3TC ou FTC+TAF (> ou = 35 kg) ‡ |
||
| 3e agent | LPV/r | DRV/r | DRV/r ou ATV/r ou DTG |
DTG ou EVG/cobi (> ou = 35 kg) ou RPV ‡* (> ou = 35 kg) ou DRV/r ou ATV/r |
|
| Alternatives | Association d'INTI | 3TC (ou FTC) + ZDV ABC* + ZDV (intérêt chez le nourrisson et/ou l'enfant dont l'observance est incertaine) |
|||
| 3e agent (par ordre de préférence) |
NVP** ou RAL*** |
LPV/r EFV ou NVP** ou RAL*** |
RAL*** EFV ou LPV/r |
||
*en l'absence d'HLA B57*01 (qui doit être recherché avant toute prescription d'ABC) ;
**éviter l'association NVP avec ABC ***à discuter en première ligne dans certaines situations exceptionnelles
‡ sous forme combinée avec elvitegravir/cobicistat ou rilpivirine
‡* si CV < 5 log10 copies/ml
En pratique
KALETRA doit être prescrit par des médecins expérimentés dans la prise en charge de l'infection par le VIH.
Tableau I - Recommandations posologiques chez l'enfant âgé de 14 jours à 6 mois
| En fonction du poids (mg/kg) | En fonction de la surface corporelle (mg/m²)* | Fréquence |
| 16/4 mg/kg (soit 0,2 mL/kg) |
300/75 mg/m² (soit 3,75 mL/m²) |
Administré deux fois par jour avec de la nourriture |
KALETRA solution buvable est administré par voie orale et doit toujours être pris au cours d'un repas.
La dose doit être administrée en utilisant la seringue pour administration orale de 2 ml ou de 5 ml correspondant au mieux au volume prescrit.
Identité administrative
La dose doit être administrée en utilisant la seringue pour administration orale de 2 ml ou de 5 ml correspondant au mieux au volume prescrit.
Identité administrative
- Liste I
- Prescription initiale hospitalière annuelle
- Renouvellement non restreint
- Boîte de 2 flacons de 60 mL + 2 seringues pour administration orale de 2 mL, CIP 3400930117293
- Remboursable à 100 % (Journal officiel du 9 octobre 2018, texte 52)
- Prix public TTC = 181,19 euros
- Agrément aux collectivités (Journal officiel du 9 octobre 2018, texte 53)
- Inscription sur la liste de rétrocession - prise en charge à 100 % (Journal officiel du 4 janvier 2019, texte 7)
- Laboratoire Abbvie
Pour aller plus loin
Avis de la Commission de la Transparence - KALETRA solution buvable (HAS, 21 février 2018)
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 6 minutes
6 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.