Les stocks résiduels de valsartan doivent être réservés aux patients ne pouvant pas bénéficier d'une alternative thérapeutique (illustration).
EDIT du 27 décembre 2018 : rappel complémentaire de tous les lots non périmés de VALSARTAN 40 mg, 80 mg et 160 mg ARROW LAB /FIN EDIT
Rappel de 400 lots de spécialités à base de valsartan
En France, un rappel de près de 400 lots de médicaments à base de valsartan, seul ou en association, a été mis en oeuvre le 29 novembre 2018 du fait qu'ils étaient possiblement concernés par un défaut de qualité, à savoir la présence d'une impureté dans le principe actif.
Ce rappel concerne les spécialités des laboratoires MYLAN et TEVA et représente plus de 60 % du marché français, selon l'ANSM dans son point d'information en date du 29 novembre dernier.
Pour les spécialités MYLAN, tous les lots non périmés des spécialités suivantes doivent être retirés du circuit de distribution :
- VALSARTAN MYLAN PHARMA 40 mg, 30 et 90 comprimés pelliculés sécables
- VALSARTAN MYLAN PHARMA 80 mg, 30 et 90 comprimés pelliculés sécables
- VALSARTAN MYLAN PHARMA 160 mg, 30 et 90 comprimés pelliculés sécables
- VALSARTAN HYDROCHLOROTHIAZIDE MYLAN PHARMA 80 mg/12,5 mg, 30 et 90 comprimés pelliculés
- VALSARTAN HYDROCHLOROTHIAZIDE MYLAN PHARMA 160 mg/12,5 mg, 30 et 90 comprimés pelliculés
- VALSARTAN HYDROCHLOROTHIAZIDE MYLAN PHARMA 160 mg/25 mg, 30 et 90 comprimés pelliculés
Pour la marque TEVA, l'alerte s'applique à certains lots des spécialités suivantes (Cf. Liste des lots) :
- VALSARTAN TEVA 40 mg comprimé pelliculé sécable, boîte de 30, CIP 3400939630939
- VALSARTAN TEVA 40 mg comprimé pelliculé sécable, boîte de 90, CIP 3400939631301
- VALSARTAN TEVA 80 mg comprimé pelliculé, boîte de 30, CIP 3400939636153
- VALSARTAN TEVA 80 mg comprimé pelliculé, boîte de 90, CIP 3400939637044
- VALSARTAN TEVA 160 mg comprimé pelliculé, boîte de 30, CIP 3400939638973
- VALSARTAN TEVA 160 mg comprimé pelliculé, boîte de 90, CIP 3400939639864
- VALSARTAN/HYDROCHLOROTHIAZIDE TEVA 80 mg/ 12,5 mg comprimé pelliculé, boîte de 30, CIP 3400939601892
- VALSARTAN/HYDROCHLOROTHIAZIDE TEVA 80 mg/ 12,5 mg comprimé pelliculé, boîte de 90, CIP 3400939602325
- VALSARTAN/HYDROCHLOROTHIAZIDE TEVA 160 mg/12,5 mg comprimé pelliculé, boîte de 30, CIP 3400939602905
- VALSARTAN/HYDROCHLOROTHIAZIDE TEVA 160 mg/12,5 mg comprimé pelliculé, boîte de 90, CIP 3400939603384
- VALSARTAN/HYDROCHLOROTHIAZIDE TEVA 160 mg/25 mg comprimé pelliculé, boîte de 30, CIP 3400939600543
- VALSARTAN/HYDROCHLOROTHIAZIDE TEVA 160 mg/25 mg comprimé pelliculé, boîte de 90, CIP 3400939601083
- AMLODIPINE/VALSARTAN TEVA 5 mg/80 mg comprimé pelliculé, boîte de 30, CIP 3400930078167
- AMLODIPINE/VALSARTAN TEVA 5 mg/80 mg comprimé pelliculé, boîte de 90, CIP 3400930078198
- AMLODIPINE/VALSARTAN TEVA 5 mg/160 mg comprimé pelliculé, boîte de 30, CIP 3400930078259
- AMLODIPINE/VALSARTAN TEVA 5 mg/160 mg comprimé pelliculé, boîte de 90, CIP 3400930078273
- AMLODIPINE/VALSARTAN TEVA 10 mg/160 mg comprimé pelliculé, boîte de 30, CIP 3400930078488
- AMLODIPINE/VALSARTAN TEVA 10 mg/160 mg comprimé pelliculé, boîte de 90, CIP 3400930078501
Une 2e impureté probablement cancérogène chez l'Homme
En juillet dernier, un premier rappel de lots d'une cinquantaine de spécialités à base de valsartan, fabriquées en Chine, avait été mis en oeuvre suite à la découverte dans la substance active d'une première impureté probablement cancérogène chez l'Homme, la N-nitrosodiméthylamine (NDMA) [notre article du 12 juillet 2018].
Poursuivant ses investigations, l'EMA (Agence européenne du médicament) a de nouveau mis en évidence la présence possible d'une autre impureté, la NDEA (N-nitrosodiéthylamine), au sein de la substance active valsartan fabriquée dans une usine Mylan située en Inde.
Comme la NDMA (N-nitrosodiméthylamine), la NDEA est classée comme probablement cancérogène chez l'Homme par l'OMS.
Par principe de précaution, l'EMA a donc décider d'interdire l'utilisation des médicaments à base de valsartan issus de cette usine, comme elle l'avait fait en juillet dernier pour ceux provenant des sites de fabrication chinois.
Recommandations aux professionnels de santé et aux patients
Ces nouveaux rappels impactent la disponibilité du valsartan sur le marché français et des ruptures de stock paraissent inévitables.
Cette situation ne peut être compensée par les spécialités de valsartan exemptes de défaut, dont le stock est limité.
Les laboratoires commercialisant des spécialités à base de valsartan, non concernées par le rappel, ne sont actuellement pas en mesure d'augmenter suffisamment leur production pour couvrir l'ensemble des besoins des patients français.
Dans ce contexte, l'ANSM réitère ses recommandations de prescription et de délivrance des médicaments à base de valsartan pour épargner les stocks résiduels et les réserver aux patients prioritaires, ne pouvant pas bénéficier d'une alternative thérapeutique (Cf. Encadrés 1 et 2).
Encadré 1 - Recommandations aux médecins
|
Encadré 2 - Recommandations aux pharmaciens
|
Ne pas arrêter brutalement le traitement par valsartan
Les patients doivent être informés sur la situation actuelle qui ne permet pas l'échange de boîtes de valsartan.
Ils doivent également être alertés sur le fait que leur traitement ne doit en aucun cas être arrêté sans avis médical (Cf. Figure 1).
Figure 1 - Valsartan : nouvelle conduite à tenir pour les patients (ANSM, 29 novembre 2018)
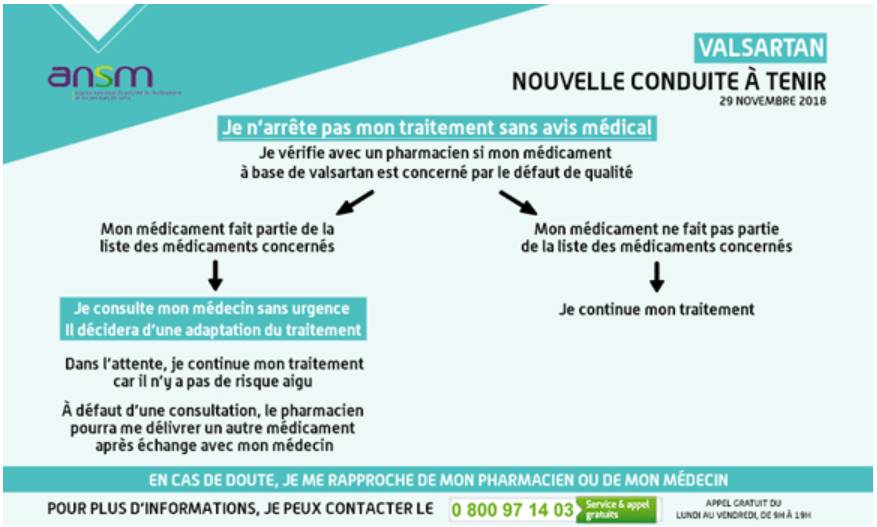
L'ANSM insiste sur les risques d'un arrêt brutal et sans avis médical d'un tel traitement : poussées hypertensives, décompensations cardiaques, accidents neurologiques.
Il convient par ailleurs de rassurer les patients actuellement traités par une spécialité de valsartan quant à l'existence de nombreuses alternatives thérapeutiques disponibles permettant d'assurer une prise en charge optimale.
Les patients devront être incités à consulter leur médecin, sans urgence, pour définir la meilleure option, au cas par cas.
Prévision des besoins français : le dispositif de l'ANSM
Chaque mois, l'ANSM actualise la liste des médicaments à base de valsartan et autres sartans disponibles en France.
Ce dispositif a été mis en place au mois de septembre.
Pour toute information, les patients peuvent également contacter le numéro vert, ouvert du lundi au vendredi 9h à 19h : 0 800 97 14 03.
Pour aller plus loin
Nouveau rappel de médicaments à base de valsartan : Informations pour les patients et les professionnels de santé - Point d'Information (ANSM, 29 novembre 2018)
Valsartan : quels sont les patients prioritaires dans un contexte d'intenses tensions d'approvisionnement ? - Lettre aux professionnels de santé (ANSM, 29 novembre 2018)
Alerte MED 18/A033 : Valsartan Mylan Pharma,Valsartan Hydrochlorothiazide Mylan Pharma, comprimé - Mylan SAS - Rappel de lots (ANSM, 29 novembre 2018)
Liste des lots des spécialités MYLAN faisant l'objet du rappel du 29 novembre 2018 (ANSM, 29 novembre 2018)
Alerte MED 18/A034/B028 Valsartan Teva, Valsartan/Hydrochlorothiazide Teva, Amlodipine/Valsartan Teva, comprimé - Teva Santé - Rappel de lots (ANSM, 29 novembre 2018)
Liste des lots des spécialités TEVA faisant l'objet du rappel du 29 novembre 2018 (ANSM, 29 novembre 2018)
Liste des médicaments de valsartan concernés par le rappel de lots - mise à jour du 20 décembre 2018 (ANSM)
Liste des médicaments de valsartan NON concernés par un rappel de lots - mise à jour du 20 décembre 2018 (ANSM)
Disponibilité des médicaments à base de valsartan et autres sartans en Franc - Mise à jour du 15 novelbre 2018 (ANSM)
Valsartan from Mylan laboratories in India can no longer be used in EU medicines due to NDEA impurity (EMA, 19 novembre 2018)
EDIT du 27 décembre 2018 : Alerte MED18/A038/B031 - Rappel des lots de VALSARTAN ARROW LAB /FIN EDIT
Sur VIDAL.fr
Spécialités de valsartan : les recommandations de l'ANSM pour préserver les stocks restants (5 septembre 2018)
Spécialités de valsartan et de valsartan/hydrochlorothiazide : important rappel de lots et recommandations de l'ANSM (12 juillet 2018)
Pour aller plus loin
Consultez les monographies VIDAL
- COTAREG 160 mg/12,5 mg cp pellic
- COTAREG 160 mg/25 mg cp pellic
- COTAREG 80 mg/12,5 mg cp pellic
- ENTRESTO 24 mg/26 mg cp pellic
- ENTRESTO 49 mg/51 mg cp pellic
- ENTRESTO 97 mg/103 mg cp pellic
- EXFORGE 10 mg/160 mg cp pellic
- EXFORGE 5 mg/160 mg cp pellic
- EXFORGE 5 mg/80 mg cp pellic
- EXFORGE HCT 10 mg/160 mg/12,5 mg cp pellic
- EXFORGE HCT 10 mg/160 mg/25 mg cp pellic
- EXFORGE HCT 5 mg/160 mg/12,5 mg cp pellic
- EXFORGE HCT 5 mg/160 mg/25 mg cp pellic
- NISIS 160 mg cp pellic
- NISIS 40 mg cp pellic séc
- NISIS 80 mg cp pellic
- NISISCO 160 mg/12,5 mg cp pellic
- NISISCO 160 mg/25 mg cp pellic
- NISISCO 80 mg/12,5 mg cp pellic
- TAREG 160 mg cp pellic
- TAREG 3 mg/ml sol buv
- TAREG 40 mg cp pellic séc
- TAREG 80 mg cp pellic
- VALSARTAN ARROW LAB 160 mg cp pellic séc
- VALSARTAN ARROW LAB 40 mg cp pellic séc
- VALSARTAN ARROW LAB 80 mg cp pellic séc
- VALSARTAN BIOGARAN 160 mg cp pellic séc
- VALSARTAN BIOGARAN 40 mg cp pellic séc
- VALSARTAN BIOGARAN 80 mg cp pellic séc
- VALSARTAN CRISTERS 160 mg cp pellic séc
- VALSARTAN CRISTERS 40 mg cp pellic séc
- VALSARTAN CRISTERS 80 mg cp pellic séc
- VALSARTAN EG 160 mg cp pellic séc
- VALSARTAN EG 40 mg cp pellic séc
- VALSARTAN EG 80 mg cp pellic séc
- VALSARTAN EVOLUGEN 160 mg cp pellic séc
- VALSARTAN EVOLUGEN 40 mg cp pellic séc
- VALSARTAN EVOLUGEN 80 mg cp pellic séc
- VALSARTAN KRKA 40 mg cp pellic séc
- VALSARTAN KRKA 80 mg cp pellic séc
- VALSARTAN RANBAXY 160 mg cp pellic
- VALSARTAN RANBAXY 40 mg cp pellic séc
- VALSARTAN RANBAXY 80 mg cp pellic
- VALSARTAN SANDOZ 160 mg cp pellic
- VALSARTAN SANDOZ 40 mg cp pellic séc
- VALSARTAN SANDOZ 80 mg cp pellic
- VALSARTAN TEVA 160 mg cp pellic séc
- VALSARTAN TEVA 40 mg cp pellic séc
- VALSARTAN TEVA 80 mg cp pellic séc
- VALSARTAN VIATRIS 40 mg cp pellic séc
- VALSARTAN ZENTIVA 160 mg cp pellic séc
- VALSARTAN ZENTIVA 40 mg cp pellic séc
- VALSARTAN ZENTIVA 80 mg cp pellic séc
- VALSARTAN ZYDUS 160 mg cp pellic
- VALSARTAN ZYDUS 40 mg cp pellic séc
- VALSARTAN ZYDUS 80 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE BIOGARAN 160 mg/12,5 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE BIOGARAN 160 mg/25 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE BIOGARAN 80 mg/12,5 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE CRISTERS 160 mg/12,5 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE CRISTERS 160 mg/25 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE CRISTERS 80 mg/12,5 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE EG 160 mg/12,5 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE EG 160 mg/25 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE EG 80 mg/12,5 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE EVOLUGEN 160 mg/12,5 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE EVOLUGEN 160 mg/25 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE EVOLUGEN 80 mg/12,5 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE KRKA 80 mg/12,5 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE RANBAXY 160 mg/12,5 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE SANDOZ 160 mg/12,5 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE SANDOZ 160 mg/25 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE SANDOZ 80 mg/12,5 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE TEVA 160 mg/12,5 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE TEVA 160 mg/25 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE TEVA 80 mg/12,5 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE VIATRIS 160 mg/12,5 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE VIATRIS 160 mg/25 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE VIATRIS 80 mg/12,5 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE ZENTIVA LAB 160 mg/12,5 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE ZENTIVA LAB 160 mg/25 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE ZENTIVA LAB 80 mg/12,5 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE ZYDUS 160 mg/12,5 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE ZYDUS 160 mg/25 mg cp pellic
- VALSARTAN/HYDROCHLOROTHIAZIDE ZYDUS 80 mg/12,5 mg cp pellic
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 6 minutes
6 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.