Les molécules antirétrovirales les plus récentes, qu’elles appartiennent à de nouvelles classes ou à des classes préexistantes, jouent un rôle important dans un contexte de résistance multiple (illustration).
Nouvelle trithérapie contre l'infection à VIH-1
BIKTARVY 50 mg/200 mg/25 mg comprimé pelliculé est une nouvelle trithérapie indiquée dans le traitement des adultes infectés par le virus de l'immunodéficience humaine de type 1 (VIH-1) sans preuve actuelle ou antérieure de résistance à la classe des inhibiteurs de l'intégrase, à l'emtricitabine ou au ténofovir (Cf. VIDAL Reco "Infection par le VIH").
BIKTARVY associe 3 antirétroviraux :
- le bictégravir (50 mg), un nouvel inhibiteur d'intégrase (INI). BIKTARVY est la première spécialité commercialisée contenant ce principe actif,
- l'emtricitabine (200 mg), inhibiteur nucléosidique de la transcriptase inverse (INTI),
- le ténofovir alafénamide (25 mg), également de la classe des INTI, et nouvelle prodrogue du ténofovir.
 BIKTARVY fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
BIKTARVY fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté. Efficacité de BIKTARVY chez des patients naïfs et des patients prétraités
Dans son avis du 5 septembre 2018, la Commission de la Transparence a évalué BIKTARVY sur la base de 5 études de phase III de non infériorité contrôlées versus comparateurs actifs, dont :
- deux études ont été conduites chez des patients adultes naïfs de traitement : études GS-US-380-1489 et GS-US-380-1490, réalisées versus une association fixe contenant du dolutégravir (INI) et 2 INTI (TRIUMEQ, ou TIVICAY plus DESCOVY). La non-infériorité de BIKTARVY (au seuil prédéfini de 12 %) a été démontrée sur la base du succès virologique obtenu à 48 semaines de traitement (critère de jugement principal, charge virale d'ARN VIH-1 inférieure à 50 copies/mL) [Cf. Tableau I].
Tableau I - Etudes 1489 et 1490 (patients naïfs) - Efficacité virologique et immunologique à la semaine 48 - Analyse FAS et PP
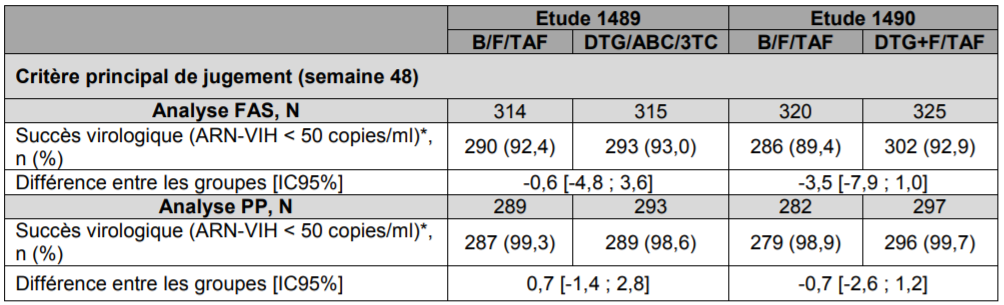
B/F/TAF : BIKTARVY, DTG/ABC/3TC : TRIUMEQ, DTG : TIVICAY, F/TAF : DESCOVY; *Analyse selon l'algorithme « snapshot » établi par la FDA : correspond à la prise en compte de la dernière valeur de la charge virale observée entre les semaines 42 et 54 pour l'analyse à 48 semaines
- et trois études ont eté menées chez des patients adultes prétraités, virologiquement contrôlés :
- études GS-US-380-1844 et GS-US-380-1878 ayant comparé l'efficacité du remplacement d'une trithérapie (TRIUMEQ ou TIVICAY plus KIVEXA) par l'association bictégravir/emtricitabine/ténofovir alafénamide (B/F/TAF : BIKTARVY). Le critère de jugement principal était la proportion de patients ayant une charge virale supérieure ou égale à 50 copies/mL (en échec virologique) à 48 semaines. Sur ce critère, la non-infériorité de BIKTARVY (au seuil prédéfini de 4 %) a été démontrée à 48 semaines (cf. Tableau II).
- étude GS-US-380-1961, réalisée spécifiquement chez des femmes prétraitées par un traitement antirétroviral à base d'atazanavir boosté (ATV/r) + TRUVADA ou GENVOYA ou STRIBILD et virologiquement contrôlées depuis au moins 12 semaines, la non-infériorité (échec virologique : charge virale supérieure ou égale à 50 copies d'ARN VIH-1 /mL) a été démontrée à 48 semaines :
- BIKTARVY versus maintien du traitement initial : 1,7 % versus 1,7 % ; différence de 0 % ; IC95 % [-2,9 ; 2,9] ;
- résultats obtenus dans la population FAS et confirmés par l'analyse PP : 1,8 % versus 1,8 % ; différence de 0 % ; IC95 % [-3 ; 3].
Tableau II - Etudes 1844 et 1878 (patients prétraités, en succès virologique) - Efficacité virologique et immunologique à la semaine 48 - analyses FAS et PP
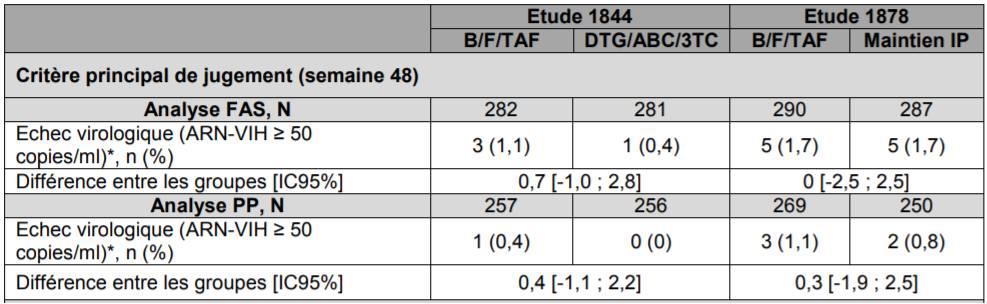
B/F/TAF : BIKTARVY, DTG/ABC/3TC : TRIUMEQ ; *Analyse selon l'algorithme « snapshot » établi par la FDA : correspond à la prise en compte de la dernière valeur de la charge virale observée entre les semaines 42 et 54 pour l'analyse à 48 semaines

B/F/TAF : BIKTARVY, DTG/ABC/3TC : TRIUMEQ ; *Analyse selon l'algorithme « snapshot » établi par la FDA : correspond à la prise en compte de la dernière valeur de la charge virale observée entre les semaines 42 et 54 pour l'analyse à 48 semaines
En termes de tolérance, le profil de BIKTARVY a été globalement favorable et comparable à celui de TRIUMEQ, notamment au niveau rénal (augmentation de la créatininémie, diminution du DFG) et osseux (DMO de la hanche et de la colonne vertébrale).
Les effets indésirables (EI) liés au traitement par BIKTARVY les plus fréquemment rapportés ont été les nausées, la diarrhée et les céphalées.
SMR important, sans ASMR, nouvelle option de 1re intention chez certains patients
Sur la base des données disponibles, la Commission de la Transparence considère que BIKTARVY (bictégravir/emtricitabine/ténofovir alafénamide) est une nouvelle option de première intention dans le traitement de l'infection par le virus de l'immunodéficience humaine de type 1 :
- uniquement chez les patients adultes naïfs ou prétraités virologiquement contrôlés,
- dont le virus ne possède pas de mutation de résistance aux inhibiteurs de l'intégrase, à l'emtricitabine ou au ténofovir.
En revanche, BIKTARVY n'a pas de place dans la stratégie thérapeutique actuelle des patients en échec virologique et des patients dont le virus est résistant aux autres inhibiteurs de l'intégrase.
Prenant en compte le profil d'efficacité, de tolérance et de résistance de BIKTARVY comparable à celui de TRIUMEQ, et l'absence de données cliniques chez les patients en échec virologique, la Commission considère que BIKTARVY apporte un service médical rendu (SMR) important, sans amélioration du SMR (ASMR V).
BIKTARVY en pratique
Le traitement doit être initié par un médecin expérimenté dans la prise en charge de l'infection par le VIH.
La posologie est de 1 comprimé 1 fois par jour, administré avec ou sans nourriture. Le comprimé pelliculé ne doit pas être croqué, écrasé ou coupé.
Le bictégravir étant un substrat du CYP3A et de l'UGT1A1, BIKTARVY est contre-indiqué chez les patients atteints de tuberculose traités par rifampicine et en association avec le millepertuis (Hypericum perforatum), au risque d'entraîner une baisse des concentrations plasmatiques de bictégravir.
Identité administrative
- Liste I
- Prescription initiale hospitalière annuelle
- Renouvellement non restreint
- Boîte de 30, CIP 3400930153031
- Prix public TTC = 738,37 euros
- Remboursable à 100 % (Journal officiel du 9 novembre 2018 - texte 12)
- Agrément aux collectivités (Journal officiel du 9 novembre 2018 - texte 13)
- Inscrit sur liste de rétrocession avec prise en charge à 100 %
- Laboratoire Gilead
Pour aller plus loin
Avis de la Commission de la Transparence - BIKTARVY (HAS, 5 septembre 2018)
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 5 minutes
5 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.