Il persiste un besoin médical dans le traitement de la PR compte tenu des phénomènes d’échappement, de réponse insuffisante, de contre-indications et d’intolérance aux traitements (illustration).
Nouveau médicament dans la polyarthrite rhumatoïde en 2e intention
KEVZARA solution injectable en stylo ou seringue préremplis (sarilumab) est une nouvelle spécialité de rhumatologie qui dispose d'une AMM européenne dans l'indication thérapeutique suivante :
- en association au méthotrexate (MTX) chez les patients adultes atteints de polyarthrite rhumatoïde (PR) active modérée à sévère ayant eu une réponse inadéquate ou intolérants à un ou plusieurs traitements de fond (DMARDs) (Cf. VIDAL Reco "Polyarthrite rhumtoïde").
- KEVZARA peut être utilisé en monothérapie en cas d'intolérance au MTX ou lorsque le traitement avec le MTX est inadapté.
KEVZARA est proposé sous 2 dosages, pour permettre les adaptations posologiques nécessaires :
- 150 mg par seringue ou stylo prérempli de 1,14 mL (soit 131,6 mg par mL)
- 200 mg par seringue ou stylo prérempli de 1,14 mL (soit 175 mg par mL)
Le principe actif de KEVZARA est le sarilumab, un anticorps monoclonal humain dirigé contre le récepteur de l'interleukine-6 (IL-6). KEVZARA est le 2e représentant de cette classe thérapeutique après le tocilizumab, commercialisé sous le nom de marque ROACTEMRA depuis 2009 (Cf. Tableau I).
Tableau I - Similitudes et différences entre les deux représentants
de la classe des Ac monoclonaux inhibiteurs de l'IL-6
de la classe des Ac monoclonaux inhibiteurs de l'IL-6
| Critères | sarilumab | tocilizumab |
| Indications dans la polyarthrite rhumatoïde | Superposables en 2e ligne de traitement | |
| _ | 1re ligne de traitement (patients naïfs de méthotrexate) où il est non remboursable (SMR insuffisant pour la voie IV, remboursement non sollicité pour la voie SC) | |
| Rythme des injections | 1 injection toutes les 2 semaines par voie SC |
1 injection toutes les semaines par voie SC |
| Formes | Seringue préremplie Stylo prérempli |
Seringue préremplie |
| Durée de conservation à température ambiante | 14 jours | 8 heures |
 KEVZARA fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
KEVZARA fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.Trois études pivots dont 2 versus placebo et 1 versus adalimumab
Dans son avis du 10 janvier 2018, la Commission de la Transparence a évalué l'efficacité et la tolérance de KEVZARA principalement sur la base de 3 études cliniques dont :
- deux étaient contrôlées versus placebo :
- MOBILITY (Arthritis Rheumatol 2015) : les critères de jugement principaux de l'efficacité ont été le taux de réponse ACR20 à la semaine 24, la variation par rapport à l'inclusion du score HAQ-DI (Health Assessment Questionnaire - Disability Index) à la semaine 16 et la variation par rapport à l'inclusion du score mTSS (score radiographique de Sharp modifié par van der Heijde) à la semaine 52.
- TARGET (Arthritis Rheumatol 2017) : les critères de jugement principaux de l'efficacité ont été le taux de réponse ACR20 à la semaine 24 et la variation du score HAQ-DI à la semaine 12.
- la 3e étude, MONARCH (Ann Rheum Dis.2017), était contrôlée versus comparateur actif, l'adalimumab (HUMIRA) : le critère principal de jugement était le score DAS28 à la semaine 24.
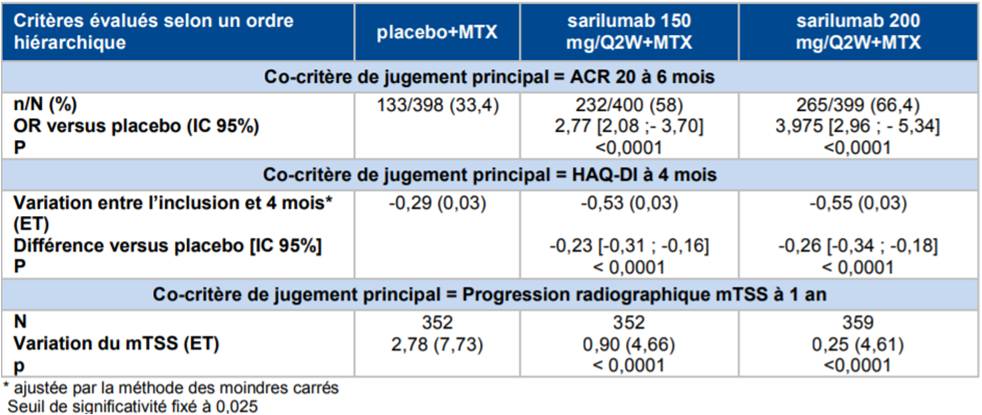
Selon les résultats de l'étude MOBILITY, réalisée chez 1 197 patients atteints de polyarthrite rhumatoïde (PR) ayant eu une réponse clinique inadéquate au méthotrexate (MTX), la supériorité du sarilumab aux posologies de 200 mg et 150 mg toutes les 2 semaines en association au MTX a été démontrée par rapport au placebo + MTX (Cf. Tableau II).
Tableau II - Résultats d'efficacité sur les 3 critères principaux de jugement hiérarchisés (population ITT) - étude MOBILITY partie 2 (d'après Avis de la Commission de Transparence relatif à KEVZARA 10, janvier 2018)
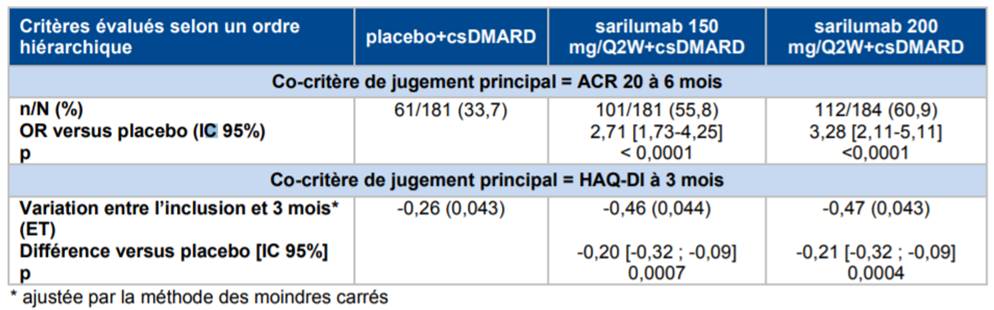
Selon les résultats de l'étude TARGET, réalisée chez 546 patients atteints de PR et ayant eu une réponse clinique inadéquate ou une intolérance à un ou plusieurs anti-TNF, la supériorité du sarilumab en association avec des traitements de fond conventionnels (MTX, sulfasalazine, léflunomide et hydroxychloroquine) a été démontrée par rapport au placebo + traitements de fond conventionnels (Cf. Tableau III).
Tableau III - Résultats d'efficacité sur les co-critères principaux de jugement (population ITT), étude TARGET (d'après Avis de la Commission de Transparence relatif à KEVZARA, 10 janvier 2018)
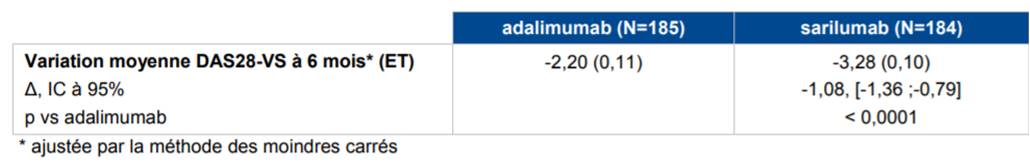
Selon les résultats de l'étude MONARCH, réalisée chez 369 patients atteints de PR active modérée à sévère et ne pouvant recevoir un traitement par MTX en raison d'une intolérance ou d'une réponse inadéquate au MTX, la supériorité du sarilumab 200 mg en monothérapie par rapport à l'adalimumab 40 mg en monothérapie a été démontrée en termes de réduction de l'activité de la maladie évaluée par le score DAS 28 (Cf. Tableau IV).
Tableau IV - Résultats d'efficacité sur le critère principal d'efficacité (population ITT), étude MONARCH (d'après Avis de la Commission de Transparence relatif à KEVZARA, 10 janvier 2018)
En termes de tolérance, le sarilumab a principalement été associé à la survenue d'infections, de neutropénie et de thrombocytopénie, d'augmentation des transaminases et des lipides, de réactions au site d'injection. Quelques cas de perforations gastro-intestinales ont été rapportés.
Service médical rendu important, sans amélioration
Sur la base des données disponibles, la Commission a attribué un service médical rendu (SMR) important à KEVZARA dans l'indication de son AMM.
Considérant la supériorité du sarilumab démontrée par rapport à l'adalimumab mais uniquement en monothérapie et dans une population limitée ne pouvant pas être traitée par du MTX, ainsi que l'absence de comparaison directe au tocilizumab d'une part et aux autres alternatives disponibles en 2e ligne ou plus de traitement (abatacept ou rituximab) d'autre part, la Commission a considéré que KEVZARA n'apportait pas d'amélioration du SMR (ASMR V) dans la stratégie de prise en charge de la polyarthrite rhumatoïde.En conclusion de son avis, la Commission place KEVZARA dans la stratégie thérapeutique comme un traitement de 2e intention après échec des traitements de fond classiques tel que le méthotrexate (MTX) ou en 3e intention (échec d'un médicament biologique) ou plus (échec de plusieurs traitements de fond classiques et/ou biologiques).
La Commission fait remarquer que "la fréquence d'administration [de KEVZARA] (toutes les 2 semaines versus toutes les semaines pour le tocilizumab) et ses modalités de conservation (14 jours à température ambiante versus 8 heures pour le tocilizumab) pourraient avoir un impact favorable sur la qualité de vie des patients mais cet impact reste à être démontré".
KEVZARA en pratique
Le traitement par KEVZARA doit être instauré et supervisé par des professionnels de santé ayant l'expérience du diagnostic et du traitement de la PR.
Avant d'initier un traitement par KEVZARA, les patients doivent faire l'objet d'une évaluation des facteurs de risque de la tuberculose et d'un dépistage d'infection latente.
- Posologie recommandée et adaptation
En cas de neutropénie, de thrombopénie ou d'élévation des enzymes hépatiques, une réduction de la posologie à 150 mg toutes les 2 semaines est recommandée.
Le traitement par KEVZARA doit être interrompu chez les patients qui développent une infection grave et ce jusqu'à ce que cette infection soit contrôlée.
- Administration : injection par un professionnel de santé ou par le patient lui-même
L'intégralité de la solution injectable contenue dans la seringue préremplie ou le stylo prérempli doit être injectée.
L'injection peut être réalisée par le patient lui-même, après accord du médecin prescripteur et formation appropriée à l'administration par voie SC.
Les sites d'injection recommandés sont l'abdomen, la cuisse et la partie supérieure du bras. Ces sites doivent être utilisés en alternance.
- Surveillance des paramètres biologiques et des signes cliniques
Une surveillance du patient doit être mise en place dès l'initiation du traitement. Cette surveillance porte sur :
- l'identification de signes d'infection ou de signes gastro-intestinaux. En effet, KEVZARA expose à un risque d'infections graves, ou de perforation gastro-intestinale) ;
- l'identification de signes d'hypersensibilité ;
- la formulation sanguine (nombre de neutrophiles et numération plaquettaire) ;
- la fonction hépatique (enzymes hépatiques ALAT et d'ASAT) et les paramètres lipidiques.
Carte patient et traçabilité produit
Les patients traités par KEVZARA doivent recevoir une carte patient lors de la prescription (Cf. Encadré 1).
Encadré 1 - Informations contenues dans la carte patient
(Extrait du RCP européen, annexe 2)
(Extrait du RCP européen, annexe 2)
|
Afin d'améliorer la traçabilité des médicaments biologiques, le nom commercial du produit administré et le N° de lot doivent être clairement consignés.
KEVZARA est à conserver au réfrigérateur (entre 2 °C et 8 °C). La seringue préremplie/le stylo prérempli doit être conservé(e) dans l'emballage extérieur d'origine, à l'abri de la lumière.
Une fois sorti du réfrigérateur, KEVZARA doit être administré sous 14 jours et doit être conservé à une température ne dépassant pas 25 °C.
Identité administrative
- Liste 1
- Médicament soumis à prescription initiale hospitalière annuelle
- Prescription initiale et renouvellement réservés aux spécialistes en rhumatologie ou en médecine interne
- Médicament nécessitant une surveillance particulière pendant le traitement
- KEVZARA 150 mg, boîte de 2 seringues préremplies unidoses de 1,14 mL de solution, CIP 3400930100608
- KEVZARA 150 mg, boîte de 2 stylos préremplis unidoses de 1,14 mL de solution, CIP 3400930100622
- KEVZARA 200 mg, boîte de 2 seringues préremplies unidoses de 1,14 mL de solution, CIP 3400930100615
- KEVZARA 200 mg, boîte de 2 stylos préremplis unidoses de 1,14 mL de solution, CIP 3400930100639
- Remboursable à 65 % selon la procédure des médicaments d'exception (Fiche d'information thérapeutique - Journal officiel du 25 septembre 2018, texte 16)
- Prix public TTC unique = 849,01 euros
- Agrément aux collectivités (Journal officiel du 25 septembre 2018, texte 17)
- Laboratoire sanofi-aventis France
Pour aller plus loin
Avis de la Commission de la Transparence - KEVZARA (HAS, 10 janvier 2018)
Etudes pivots :
Genovese MC et al. Sarilumab plus methotrexate in patients with active rheumatoid arthritis and inadequate response to methotrexate: results of a phase iii study. Arthritis Rheumatol 2015;67:1424-37
Fleishmann R et al. Sarilumab and nonbiologic disease-modifying antirheumatic drugs in patients with active rheumatoid arthritis and inadequate response or intolerance to tumor necrosis factor inhibitors. Arthritis Rheumatol 2017;69:277-90
Burmester GR et al. Efficacy and safety of sarilumab monotherapy versus adalimumab monotherapy for the treatment of patients with active rheumatoid arthritis (MONARCH): a randomised, double-blind, parallel-group phase III trial. Ann Rheum Dis.2017 ;76(5):840-7
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 8 minutes
8 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.