Le dispositif ou système intra-utérin, anciennement appelé stérilet, est un contraceptif inventé en 1928 par Ernst Gräfenberg (illustration).
Nouveau système de contraception intra-utérin au lévonorgestrel
KYLEENA est un nouveau système intra-utérin (SIU) dosé à 19,5 mg de lévonorgestrel, indiqué dans la contraception pour une durée maximale de 5 ans.
Le dosage de KYLEENA en lévonorgestrel (19,5 mg) est intermédiaire entre ceux des deux autres SIU au lévonorgestrel déjà disponibles :
- MIRENA (52 mg) indiqué dans la contraception pour une durée maximale de 5 ans,
- JAYDESS (13,5 mg) indiqué dans la contraception pour une durée maximale de 3 ans.
Particularités du système intra-utérin KYLEENA
KYLEENA se distingue des autres SIU par la présence d'un anneau d'argent visible à l'échographie et par la couleur bleue des fils de retrait.
Sa structure en T contient du sulfate de baryum visible à la radiographie.
KYLEENA est fourni avec un inserteur constitué d'un tube d'insertion courbé, d'une bague, d'un poussoir et d'une butée intégrés à une poignée avec curseur (Cf. Figure 1).
Figure 1 - Schéma représentant KYLEENA dans son emballage stérile ouvert
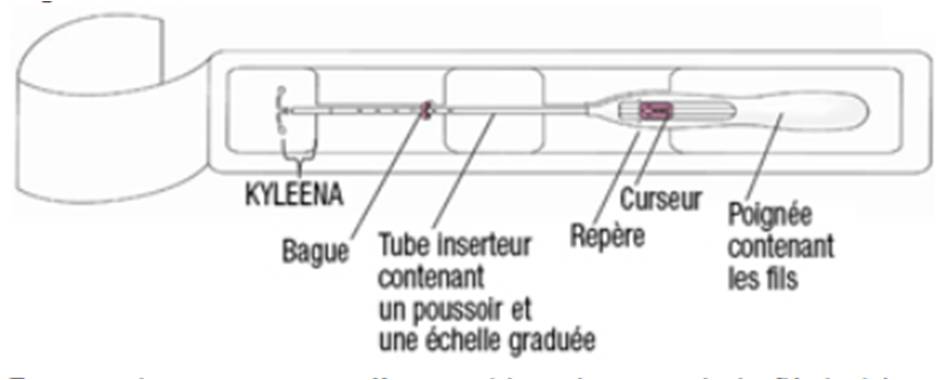
La tige verticale du système intra-utérin est placée dans le tube d'insertion.
Les fils de retrait sont situés à l'intérieur du tube d'insertion et de la poignée.
Des mesures de réduction des risques de confusion entre les 3 SIU
Dans le cadre du plan de gestion des risques (PGR) prévu par l'autorisation de mise sur le marché (AMM) de KYLEENA, le laboratoire Bayer Healthcare propose aux professionnels de santé un document dont l'objectif est de réduire les risques de confusion entre les 3 SIU au lévonorgestrel (KYLEENA, JAYDESS et MIRENA) : les éléments permettant de les différencier, une fois posés notamment, y sont présentés.
Une fiche d'information commune aux 3 SIU est par ailleurs mise à disposition afin d'informer les patientes sur les bénéfices, les risques et les effets indésirables de cette méthode contraceptive avant la pose, et notamment sur le risque de grossesse extra-utérine et de perforation utérine.
Lorsque le choix de la contraception s'oriente vers un SIU au lévonorgestrel, cette fiche d'information doit être remise à la patiente.
Ces deux documents sont à la disposition des professionnels de santé sur demande par e-mail au laboratoire Bayer Healthcare : demande_materiel.santefemme@bayer.com.
La fiche d'information est également accessible sur le site VIDAL.fr en regard de la monographie de KYLEENA ou directement en cliquant ici.
SMR important, pas d'ASMR par rapport à JAYDESS et MIRENA, contraceptif de 2e intention après les DIU au cuivre
Dans son avis du 13 décembre 2017, la Commission de la transparence à évalué l'efficacité et la tolérance de KYLEENA sur la base de 3 études non publiées dont :
- une étude de recherche de dose (A46796), où KYLEENA (libérant 16 µg/24h de lévonorgestrel in vitro) et SIU-LNG 12 (12 µg/24h, d'une longueur inférieure de 2 mm au SIU commercialisé : JAYDESS) ont été comparés à MIRENA (20 µg/24h) pendant 3 ans de traitement ;
- une étude (A52238) ayant comparé l'efficacité et la sécurité de KYLEENA à celle de JAYDESS pendant 3 ans de traitement ;
- une étude d'extension de l'étude A52238 (étude PH-37274), où la sécurité d'emploi et l'efficacité de KYLEENA ont été évaluées à 5 ans.
Le critère principal de jugement était, pour ces trois études, le taux de grossesses non désirées, estimé par l'indice de Pearl (nombre de grossesses observées pour 100 années-femmes), calculé sur l'ensemble des patientes ayant eu une insertion réussie (A46796) ou une tentative d'insertion (études A52238 et PH-37274). Ces études n'ont pas inclus de tests statistiques.
Selon les résultats de ces études, l'indice de Pearl de KYLEENA a été de :
- 0,82 [0,27 ; 1,92] versus 0,00 [0,00-0,59] pour MIRENA dans la première étude, de faible effectif (n = 239, 245 et 254 dans les groupes SIU-LNG 12, KYLEENA et MINENA respectivement) ;
- 0,31 [0,15 ; 0,57] versus 0,33 pour JAYDESS [0,16 ; 0,60] dans la 2e étude, d'effectif plus important (n = 1 432 et 1 452 dans les groupes JAYDESS et KYLEENA) ;
- 0,29 [0,16; 0,50] dans l'étude d'extension (5 ans de contraception).
La durée des saignements par période de 90 jours (critère de jugement secondaire) a diminué au cours de chacune des études pour atteindre une moyenne de :
- 10,6 jours avec KYLEENA et de 8,8 jours avec MIRENA à 3 ans dans la première étude,
- de 10,2 jours avec KYLEENA et 13,4 jours avec JAYDESS à 3 ans dans la seconde,
- et de 9,3 jours avec KYLEENA à la fin de l'étude d'extension (5 ans).
Le pourcentage de patientes ayant une aménorrhée par période de 90 jours (critère de jugement secondaire) a augmenté en cours d'étude pour atteindre :
- 18,9% avec KYLEENA et 23,6% pour MIRENA à la fin de la première étude,
- 20,8% avec KYLEENA et 11,4% avec JAYDESS à la fin de la seconde,
- et 22,6% à la fin de l'étude d'extension avec KYLEENA.
En termes de tolérance, les événements indésirables les plus fréquents ont été :
- dans l'étude A46796 : céphalée, acné, tension mammaire, tension abdominale, troubles de l'humeur, kyste ovarien ;
- dans l'étude A52238 : kyste ovarien, acné, infection urinaire, céphalée, dysménorrhée.
Sur la base de ces données, la Commission de la transparence considère que KYLEENA apporte un service médical rendu (SMR) important, sans amélioration du SMR par rapport à JAYDESS et MIRENA (ASMR V).
Elle place KYLEENA dans la stratégie contraceptive comme un moyen contraceptif de 2e intention après les DIU au cuivre, comme les autres DIU libérant du lévonorgestrel.
KYLEENA en pratique
La pose et le retrait de KYLEENA sont exclusivement réservées aux professionnels de santé formés.
La pose de KYLEENA dans la cavité utérine doit être réalisée au cours des 7 jours suivant le début des règles.
Ce dispositif peut être posé immédiatement après un avortement au premier trimestre.
Un examen de contrôle doit être réalisé 4 à 6 semaines après l'insertion afin de contrôler les fils et de vérifier que le système est correctement positionné. Ce contrôle doit ensuite être reconduit 1 fois par an (plus souvent si besoin).
Le remplacement par un nouveau dispositif peut intervenir à n'importe quelle période du cycle. Dans ce cas, le nouveau système doit être inséré immédiatement après le retrait de l'ancien, pour assurer une contraception continue.
Accompagnement de la patiente
Après insertion de KYLEENA, il convient de remette à la patiente la notice figurant dans la boîte ainsi que la carte patiente complétée.
La patiente doit être prévenue que des saignements irréguliers et des spottings sont fréquents au cours des premiers mois d'utilisation.
Chez les patientes diabétiques porteuses de KYLEENA, la glycémie doit être surveillée. Le lévonorgestrel à faible dose peut affecter la tolérance au glucose.
KYLEENA ne doit pas être utilisé en tant que contraception post-coïtale.
Informer sur le risque de grossesse extra-utérine
Les patientes doivent être informées sur le risque de grossesse extra-utérine et sur les signes et symptômes nécessitant de consulter en urgence le médecin :
- douleur abdominale basse, en particulier :
- si elle s'accompagne d'une absence de menstruation,
- ou si des saignements apparaissent chez une femme jusque-là en aménorrhée.
Identité administrative
- Liste I
- Boîte unitaire, CIP 3400930094754
- Remboursable à 65 % (Journal officiel du 13 mars 2018 - texte 8)
- Prix public TTC = 99,42 euros
- Agrément aux collectivités (Journal officiel du 13 mars 2018 - texte 9)
- Laboratoire Bayer Healthcare
Pour aller plus loin
Avis de la Commission de la transparence (HAS, 13 décembre 2017)
Fiche d'information patiente
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 6 minutes
6 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.