Depuis le 1er janvier 2018, les vaccinations obligatoires doivent être réalisées dans les 18 premiers mois de l'enfant (illustration).
Nouveau vaccin hexavalent
VAXELIS suspension injectable IM est un vaccin hexavalent (D-T-Polio-Ca-Hib-HepB) indiqué chez les nourrissons à partir de l'âge de 6 semaines pour la primovaccination et la vaccination de rappel contre la diphtérie, le tétanos, la coqueluche, l'hépatite B, la poliomyélite et les maladies invasives à Haemophilus influenzae de type b (Hib).
Depuis le 1er janvier 2018, ces 6 vaccinations sont obligatoires en France.
Pour rappel, sauf contre-indication médicale validée, les vaccinations obligatoires doivent être réalisées dans les 18 premiers mois de l'enfant et sont exigibles pour l'entrée ou le maintien en collectivité à partir du 1er juin 2018 pour tout enfant né à partir du 1er janvier 2018.
 VAXELIS fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité (Cf. Infos Pratiques VIDAL - Médicaments sous surveillance renforcée).
VAXELIS fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité (Cf. Infos Pratiques VIDAL - Médicaments sous surveillance renforcée).Les professionnels de santé déclarent tout effet indésirable suspecté (Cf. ANSM - Déclarer un effet indésirable : mode d'emploi).
Composition de VAXELIS en détail
VAXELIS contient les antigènes suivants :
- l'anatoxine diphtérique (supérieur ou égal à 20 UI),
- l'anatoxine tétanique (supérieur ou égal à 40 UI),
- 5 composants coquelucheux acellulaires (20 µg d'anatoxine pertussique, 20 µg d'hémagglutinine filamenteuse, 3 µg de pertactine et 5 µg de fimbriae de type 2 et 3),
- les virus poliomyélitiques inactivés type 1 (40 UD), 2 (8 UD) et 3 (32 UD),
- le polyoside capsulaire d'Hib (3 µg) conjugué à la protéine méningococcique (PRP-OMPc),
- les antigènes de surface de l'hépatite B (10 µg), produits sur cellules de levure Saccharomyces cerevisiae grâce à une technologie d'ADN recombinant.
Ces antigènes sont utilisés dans d'autres vaccins déjà commercialisés en Europe, dont la France, et aux Etats-Unis (REPEVAX et HBVAXPRO), à l'exception de l'antigigène Hib PRP-OMPc.
Troisième vaccin hexavalent pour la vaccination des nourrissons
VAXELIS est le troisième vaccin hexavalent commercialisé en France pour la vaccination des nourrissons.
Il s'ajoute à INFANRIX HEXA (GlaxoSmithKline) et à HEXYON (Sanofi Pasteur).
Les indications de ces différents vaccins sont les mêmes.
La mise à disposition de nouvelles alternatives peut être utile, selon la Commission de la transparence (Cf. avis du 11 octobre 2017), "notamment pour la gestion des situations de tensions d'approvisionnement, fréquemment rencontrées avec les vaccins".
VAXELIS versus autres vaccins hexavalents
Dans son avis du 11 octobre 2017, la Commission de la transparence a évalué l'immunogénicité et la tolérance de VAXELIS sur la base essentiellement de 4 études présentées dans le tableau I.
Tableau I - Principales études d'immunogénicité réalisées avec VAXELIS
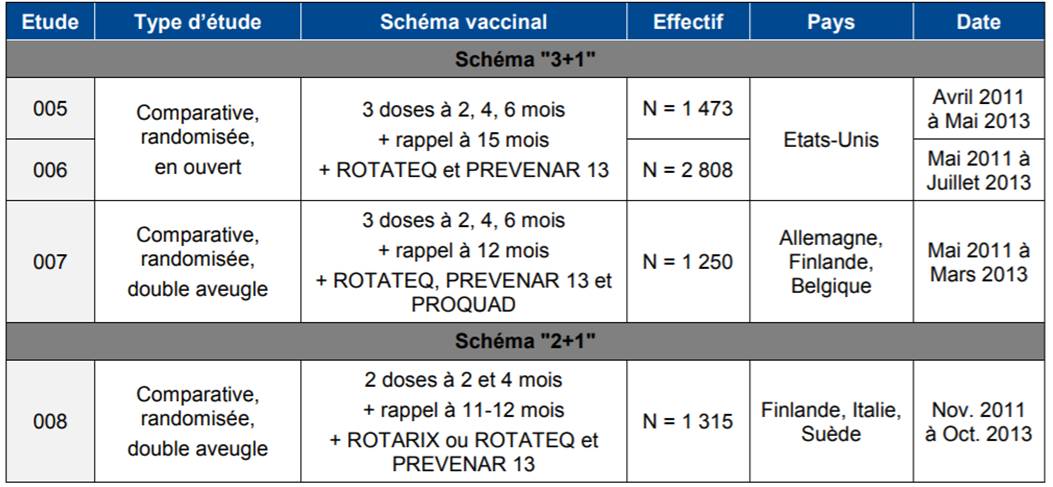 Etude 005 : Marshall GS et Coll. Pediatrics 2015 ; étude 006 : Block SL et Coll. Pediatr Infect Dis J 2017 ; étude 007 : Silfverdal SA et Coll. Vaccine 2016 (abstract) ; étude 008 : Vesikari T et Coll. Pediatr Infect Dis J 2017 (abstract).
Etude 005 : Marshall GS et Coll. Pediatrics 2015 ; étude 006 : Block SL et Coll. Pediatr Infect Dis J 2017 ; étude 007 : Silfverdal SA et Coll. Vaccine 2016 (abstract) ; étude 008 : Vesikari T et Coll. Pediatr Infect Dis J 2017 (abstract).Selon les résultats de ces études, la réponse vaccinale a été satisfaisante (supérieure aux seuils protecteurs préfinis) et non inférieur par rapport à INFANRIX HEXA, pour l'ensemble des valences vaccinales (schéma 2+1).
En termes de tolérance, le profil de VAXELIS est considéré comme satisfaisant et proche de celui du vaccin INFANRIX HEXA malgré une fréquence plus importante des réactions locales et de fièvres.
En l'absence de données d'interchangeabilité entre ces vaccins hexavalents, tout schéma vaccinal débuté avec un vaccin hexavalent doit être poursuivi avec le même vaccin hexavalent.
Aucune donnée d'immunogénicité n'est par ailleurs disponible chez les nourrissons immunodéprimés ou âgés de plus de 15 mois.
En conclusion de son avis, la Commission considère que VAXELIS apporte un service médical rendu (SMR) important sans amélioration du SMR (ASMR V) dans son indication d'AMM (autorisation de mise sur le marché) par rapport aux autres vaccins hexavalents disponibles actuellement.
VAXELIS en pratique
L'utilisation de VAXELIS doit se faire conformément aux recommandations officielles.
Selon les recommandations en vigueur, le schéma posologique chez les nourrissons, à partir de 6 semaines, comprend :
- 1 dose de vaccin hexavalent à 2 mois,
- 1 dose à 4 mois,
- 1 dose de rappel à 11 mois.
L'injection est intramusculaire (IM).
Les sites d'injection recommandés sont la partie antérolatérale du haut de la cuisse (site de préférence chez les enfants âgés de moins de un an) et le muscle deltoïde du haut du bras.
- Avant l'injection
Avant l'administration, la seringue préremplie doit être agitée doucement jusqu'à obtention d'une suspension trouble, blanchâtre, homogène.
L'aiguille doit être fixée fermement sur la seringue préremplie (système Luer-Lok), en opérant une rotation d'un quart de tour.
Si des particules étrangères sont observées dans la suspension injectable, le vaccin ne doit pas être injecté.
- Cas particulier de la vaccination précoce contre l'hépatite B
Si une deuxième dose de vaccin de l'hépatite B doit être administrée avant cet âge, un vaccin monovalent de l'hépatite B doit être utilisé.
Identité administrative
- Liste I
- Boîte de 1 seringue préremplie de 0,5 mL + 2 aiguilles, CIP 3400930079799
- Remboursable à 65 % (Journal officiel du 30 mars 2018 - texte 23)
- Prix public TTC = 37,49 euros
- Agrément aux collectivités (Journal officiel du 30 mars 2018 - texte 24)
- Laboratoire MSD Vaccins
Pour aller plus loin
Recommandations : utilisation du vaccin hexavalent VAXELIS pour la vaccination des nourrissons (HAS, octobre 2017)
Avis de la Commission de la transparence (HAS, 11 octobre 2017)
Calendrier des vaccinations et recommandations vaccinales 2018
Les études pivot
Marshall G.S. et al. Immunogenicity, Safety, and Tolerability of a Hexavalent Vaccine in Infants. Pediatrics. 2015. 136, e323-e332.
Block SL et al. Lot-to-Lot Consistency, Safety, Tolerability, and Immunogenicity of an Investigational Hexavalent Vaccine in US Infants. Pediatr Infect Dis J. 2017 Feb;36:202-208.
Silfverdal S.A. et al. A phase III randomized, double-blind, clinical trial of an investigational hexavalent vaccine given at 2, 4, and 11-12 months. Vaccine. 2016. 34:3810-16 (abstract).
Vesikari T, Becker T, Vertruyen AF, et coll. A Phase III Randomized, Double-blind, Clinical Trial of an Investigational Hexavalent Vaccine Given at Two, Three, Four and Twelve Months. Pediatr Infect Dis J. 2017 Feb;36:209-215 (abstract).
Sur VIDAL.fr
Calendrier des vaccinations et recommandations vaccinales 2018 : obligations et nouveautés (15 février 2018)
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 5 minutes
5 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.