
Le passage en ville des AAD permet de faciliter l'accès des patients aux traitements contre l'hépatite C chronique (illustration).
Passage en ville de 3 spécialités indiquées dans la prise en charge de l'hépatite C chronique
Trois médicaments de la classe des antiviraux d'action directe (AAD), indiqués dans le traitement de l'hépatite C chronique (Cf. VIDAL Reco "Hépatite C"), sortent de la réserve hospitalière et peuvent désormais être délivrés en pharmacie de ville.
Commercialisées par le laboratoire Gilead, ces 3 spécialités ont pour principe actif le sofosbuvir seul ou en association :
- SOVALDI 400 mg comprimé pelliculé (sofosbuvir)
- HARVONI 90 mg/400 mg comprimé pelliculé ( sofosbuvir et lédipasvir)
- EPCLUSA 400 mg/100 mg comprimé pelliculé (sofosbuvir et velpatasvir)
Ce passage en ville s'inscrit, entre autres, dans le cadre des mesures destinées à éliminer l'infection par le VHC en France d'ici 2025, appelées par les experts de l'Association française pour l'étude du foie (AFEF) dans leurs recommandations publiées récemment (notre article du 21 mars 2018)
Un total de 5 AAD désormais distribués en ville
La distribution en ville de ces 3 spécialités porte à 5 le nombre d'antiviraux d'action directe disponibles en pharmacie d'officine pour la prise en charge thérapeutique de l'hépatite C chronique.
Elles s'ajoutent en effet à :
- MAVIRET 100 mg/40 mg comprimé pelliculé (glécaprévir et pibrentasvir) du laboratoire Abbvie (notre article du 14 mars 2018),
- et VOSEVI 400 mg/100 mg/100 mg comprimé pelliculé (sofosbuvir, velpatasvir, voxilaprévir) du laboratoire Gilead (notre article du 4 avril 2018).
Prise en charge de l'hépatite C chronique : en pratique
La stratégie thérapeutique actuelle de l'hépatite C chronique repose sur les combinaisons à base d'AAD, sans interféron.
Dans certains cas, l'ajout de la ribavirine permet de prévenir l'impact clinique des résistances virologiques.
Aucun traitement ne pouvant être considéré comme optimal pour tous les patients, il importe d'utiliser le traitement le mieux adapté à chaque situation clinique et virologique.
Le choix du traitement doit être individualisé, en accord avec le patient, l'objectif étant d'atteindre une efficacité maximale alliée à la meilleure observance, en raison du risque de développement de résistances.
En 2018, la majorité des patients peut désormais bénéficier d'un traitement de 8 à 12 semaines sans ribavirine. Ces schémas, sans ribavirine, doivent être privilégiés.
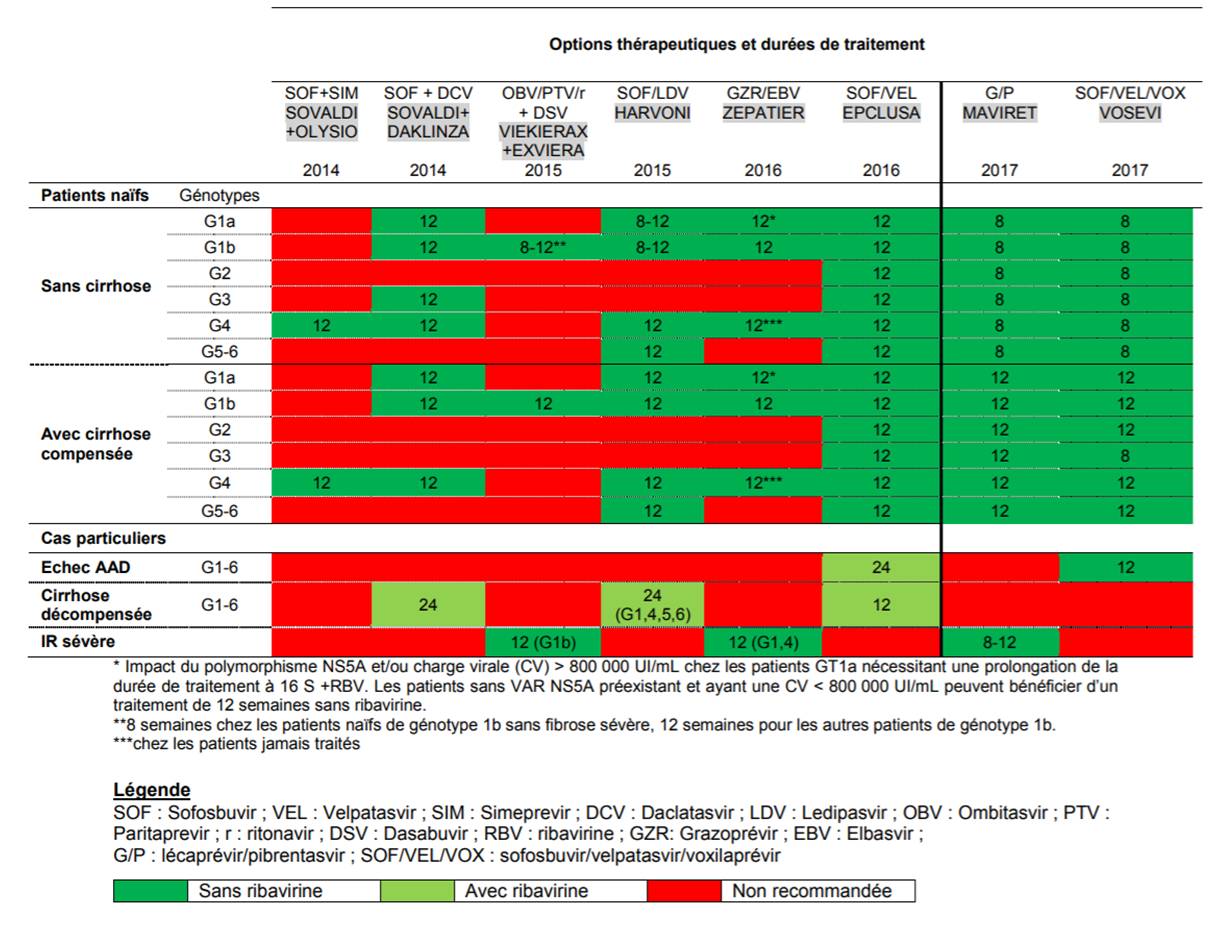
Cependant, pour les populations particulières (échec d'un traitement AAD antérieur, cirrhose décompensée, insuffisance rénale sévère, etc.), des incertitudes persistent quant au schéma le plus approprié (durée optimale du traitement, rôle de la ribavirine et gestion des interactions médicamenteuses) : chez ces patients, les traitements seront mis en place dans le cadre des résumés des caractéristiques du produit (RCP), en tenant compte des recommandations thérapeutiques (Cf. Tableau I).
Tableau I - Schémas thérapeutiques chez les patients naïfs sans cirrhose ou avec cirrhose compensée (options sans ribavirine) et cas particuliers (options avec ou sans ribavirine), pour les génotypes couverts par les AMM
(d'après Commission de la transparence - Avis du 6 décembre 2017 sur VOSEVI)
(d'après Commission de la transparence - Avis du 6 décembre 2017 sur VOSEVI)
Identité administrative
- Liste I
- Prescription hospitalière réservée aux spécialistes en gastro-entérologie et hépatologie, en médecine interne ou en infectiologie
- Remboursable à 100 %
- EPCLUSA, boîte de 28, CIP 3400930067314, prix public = 9 907,22 euros (Journal officiel du 29 mars 2018, texte 21)
- HARVONI, boîte de 28, CIP 3400930000885, prix public = 14 796,02 euros (Journal officiel du 29 mars 2018, texte 22)
- SOVALDI, Boîte de 28, CIP 3400927707070, prix public = 9 897,70 euros (Journal officiel du 29 mars 2018, texte 23)
- Agrément aux collectivités (sauf chez l'adolescent et l'enfant pour HARVONI et SOVALDI)
- Inscription sur la liste de rétrocession avec prise en charge à 100 % (sauf chez l'adolescent et l'enfant pour HARVONI et SOVALDI)
- Laboratoire Gilead Sciences
Conditions de prise en charge communes à tous les AAD
dont EPCLUSA, HARVONI et SOVALDI
dont EPCLUSA, HARVONI et SOVALDI
Au vu des exigences de qualité et de sécurité des soins, la prise en charge de la spécialité pharmaceutique qui figure dans la présente annexe est subordonnée au respect de la condition relative à l'organisation des soins suivante : l'initiation du traitement est subordonnée à la tenue d'une réunion de concertation pluridisciplinaire et ce uniquement pour les patients :
|
Pour aller plus loin
Recommandations AFEF pour l'élimination de l'infection par le virus de l'hépatite C en France (mars 2018)
Prise en charge de l'hépatite C par les médicaments antiviraux d'action directe (AAD) - Élargissement du périmètre de remboursement (Haute autorité de santé, décembre 2016)
Avis de la Commission de la transparence - EPCLUSA (HAS, 19 octobre 2016)
Avis de la Commission de la transparence - HARVONI (HAS, 4 mars 2015)
Avis de la Commission de la transparence - SOVALDI (HAS, 14 mai 2014)
Sur VIDAL.fr
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 4 minutes
4 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.