Représentation en 3D de virus de l'hépatite C (illustration).
Nouvel antiviral d'action directe disponible en ville
VOSEVI comprimé pelliculé est un nouveau médicament de la classe des antiviraux d'action directe (AAD), mis à disposition dans les pharmacies de ville.
VOSEVI est indiqué dans le traitement de l'infection chronique par le virus de l'hépatite C (VHC) chez les adultes (Cf. VIDAL Reco « Hépatite C »).
Il est le premier médicament AAD disposant d'une autorisation de mise sur le marché (AMM) chez les patients en échec aux traitements par les AAD actuellement disponibles avec, dans cette situation, une durée de traitement de 12 semaines quel que soit le génotype viral.
VOSEVI associe 3 principes actifs pangénotypiques (génotypes 1 à 6):
- le sofosbuvir (inhibiteur de la polymérase NS5B), principe actif de SOVALDI, d'EPCLUSA (en association avec le velpatasvir) et d'HARVONI (en association avec le lédipasvir) : 400 mg par comprimé
- le velpatasvir (inhibiteur de la polymérase NS5A), principe actif d'EPCLUSA (en association avec le sofosbuvir) : 100 mg par comprimé
- le voxilaprévir, un nouvel AAD (inhibiteur de la protéase NS3A/4A) : 100 mg par comprimé
 VOSEVI fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité (Cf. Infos Pratiques VIDAL - Médicaments sous surveillance renforcée). Les professionnels de santé déclarent tout effet indésirable suspecté (Cf. ANSM - Déclarer un effet indésirable : mode d'emploi).
VOSEVI fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité (Cf. Infos Pratiques VIDAL - Médicaments sous surveillance renforcée). Les professionnels de santé déclarent tout effet indésirable suspecté (Cf. ANSM - Déclarer un effet indésirable : mode d'emploi). Durée de traitement réduite et efficacité chez les patients en échec des autres AAD disponibles
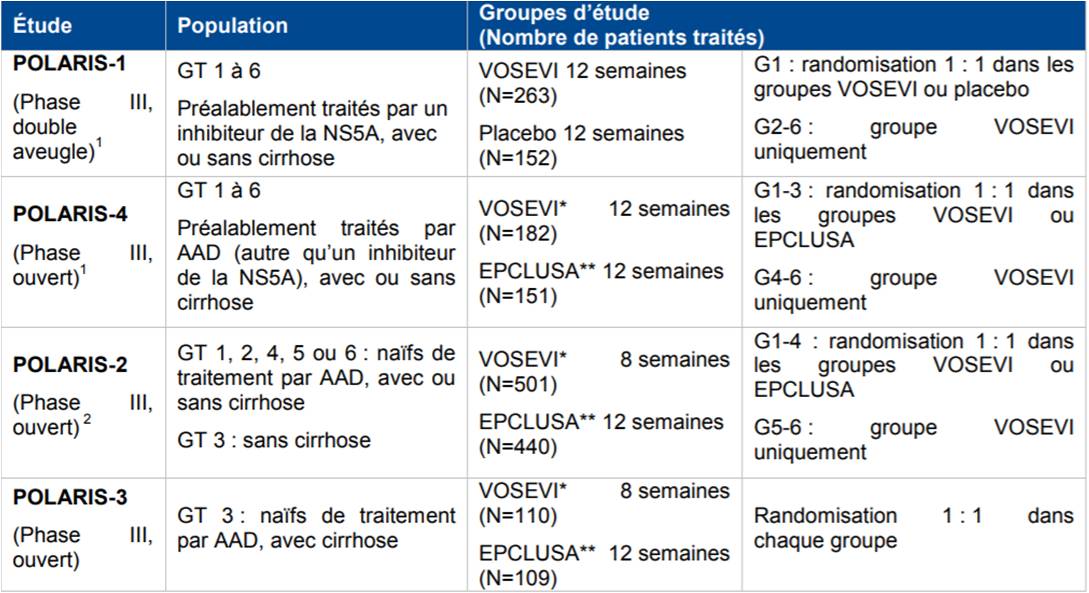
Dans son avis du 6 décembre 2017, la Commission de la transparence a évalué l'efficacité et la sécurité de VOSEVI sur la base de 4 études de phase III conduites chez des patients naïfs ou déjà traités par AAD (Cf. Tableau I).
Tableau I - Principales études réalisées avec VOSEVI
(d'après avis de la Commission de la transparence du 6 décembre 2017)
(d'après avis de la Commission de la transparence du 6 décembre 2017)

AAD : antiviraux à action directe ; GT : génotype ; *VOSEVI devait être administré avec des aliments et EPCLUSA sans contrainte alimentaire ; **EPCLUSA = sofosbuvir/velpatasvir ; (1) NEJM 2017 ; (2) Gastroenterology 2017
Le critère principal de jugement était la réponse virologique soutenue, définie par un ARN du VHC inférieur à la limite inférieure de quantification 12 semaines après la fin du traitement.
Les résultats de ces études ont montré une efficacité importante (guérison virologique > 90 %), pangénotypique, avec 8 à 12 semaines de traitement, sans adjonction de ribavirine.
Selon la Commission de la transparence, l'intérêt de VOSEVI par rapport à EPCLUSA ou aux autres alternatives disponibles, est :
Les résultats de ces études ont montré une efficacité importante (guérison virologique > 90 %), pangénotypique, avec 8 à 12 semaines de traitement, sans adjonction de ribavirine.
Selon la Commission de la transparence, l'intérêt de VOSEVI par rapport à EPCLUSA ou aux autres alternatives disponibles, est :
- "la réduction de la durée de traitement en particulier chez les patients de génotype 3 (8 semaines), naïfs de traitement par AAD, sans cirrhose ou avec cirrhose compensée,
- son efficacité chez les patients en échec des AAD actuellement disponibles, avec une durée de traitement de 12 semaines pour tous les patients quel que soit le génotype viral. Pour ces patients, les options thérapeutiques disponibles sont très limitées et insuffisamment validées".
En termes de tolérance et de résistance, le profil de VOSEVI est satisfaisant et comparable à celui observé avec EPCLUSA. Les événements indésirables considérés comme liés au traitement les plus fréquemment rapportés ont été les céphalées (20,4%), la fatigue (17,3%), la diarrhée (13,4%) et les nausées (12,6%).
Doivent être pris en compte le risque de réactivation du VHB commun à l'ensemble des AAD et le risque de bradycardie sévère et de troubles de la conduction lié à l'utilisation de spécialités à base de sofosbuvir en association avec l'amiodarone.
Comme les autres spécialités contenant un inhibiteur de la protéase NS3A/4A, l'utilisation de VOSEVI n'est pas recommandée chez les patients ayant une maladie hépatique décompensée, contrairement à EPCLUSA qui ne contient pas d'inhibiteur de la protéase NS3A/4A.
Au terme de cette évaluation, la Commission a considéré que VOSEVI apporte un service médical rendu (SMR) important et une amélioration du SMR mineure (ASMR IV) dans la stratégie de prise en charge des patients adultes infectés par le VHC de génotypes 1 à 6.
VOSEVI en pratique
Le traitement par VOSEVI doit être initié et surveillé par un médecin expérimenté dans la prise en charge des patients infectés par le VHC (Cf. Infra Encadré 1).
La dose recommandée de VOSEVI est de 1 comprimé par voie orale 1 fois par jour, à prendre avec de la nourriture.
En raison de son goût amer, il est recommandé de ne pas croquer ni écraser le comprimé pelliculé.
La durée de traitement est de 8 ou 12 semaines. Elle est déterminée en fonction du profil du patient, quel que soit le génotype du VHC (Cf. Tableau II).
| Population de patients | Durée du traitement |
| Patients naïfs de traitement par AAD sans cirrhose | 8 semaines |
| Patients naïfs de traitement par AAD avec une cirrhose compensée | 12 semaines 8 semaines peuvent être envisagées chez les patients infectés par le génotype 3 |
| Patients préalablement traités par AAD* sans cirrhose ou avec une cirrhose compensée | 12 semaines |
AAD : antiviraux à action directe.
* Dans les essais cliniques, les patients préalablement traités par AAD ont été exposés à des associations de traitements contenant l'un des AAD suivants : daclatasvir, dasabuvir, elbasvir, grazoprévir, lédipasvir, ombitasvir, paritaprévir, sofosbuvir, velpatasvir, voxilaprévir (administrés avec le sofosbuvir et le velpatasvir pendant moins de 12 semaines).Attention à certaines associations médicamenteuses
VOSEVI est contre-indiqué en cas de co-administration avec les classes de médicaments, médicaments ou produits suivants :
- les puissants inducteurs de la glycoprotéine P (P-gp) et/ou les puissants inducteurs du cytochrome P450 (CYP) : par exemple, rifampicine, rifabutine, millepertuis (Hypericum perforatum), carbamazépine, phénobarbital et phénytoïne. Ces médicaments peuvent diminuer l'exposition plasmatique à VOSEVI ;
- la rosuvastatine ou le dabigatran étexilate ;
- les médicaments contenant de l'éthinylestradiol comme les contraceptifs oraux combinés ou les anneaux vaginaux contraceptifs, en raison d'un risque d'élévations d'alanine aminotransférase (ALAT).
Un traitement antiarythmique par amiodarone ne doit être envisagé chez des patients traités par VOSEVI qu'en cas d'intolérance ou de contre-indication aux autres traitements anti-arythmiques.
Si l'amiodarone est utilisée ou a été utilisée au cours du mois précédent un traitement par VOSEVI, une surveillance étroite doit être mise en place lors de l'initiation du traitement par VOSEVI.
En cas de risque élevé de bradyarythmie, les patients doivent faire l'objet d'une surveillance continue 48 heures en milieu hospitalier adapté.
Identité administrative
- Liste I
- Prescription hospitalière réservée aux spécialistes en gastro-entérologie et hépatologie, en médecine interne ou en infectiologie
- Boîte de 28, CIP 3400930110287, UCD 3400894306535
- Remboursable à 100 % (Journal officiel du 29 mars 2018 - texte 19)
- Prix public TTC = 14 424,12 euros
- Agrément aux collectivités (Journal officiel du 29 mars 2018 - texte 20)
- Inscrit sur la liste de rétrocession avec prise en charge à 100 %
- Laboratoire Gilead Sciences
Encadré 1 - Conditions de prise en charge communes à tous les AAD
|
Au vu des exigences de qualité et de sécurité des soins, l'agrément à l'usage des collectivités et la prise en charge de cette spécialité pharmaceutique sont subordonnés au respect de la condition relative à l'organisation des soins suivante : l'initiation du traitement est subordonnée à la tenue d'une réunion de concertation pluridisciplinaire, et ce, uniquement pour les patients :
|
Pour aller plus loin
Avis de la Commission de la transparence (HAS, 6 décembre 2017)
Les études pivot
Bourlière M, Gordon SC, Flamm SL et al. Sofosbuvir, Velpatasvir, and Voxilaprevir for Previously Treated HCV Infection. N Engl J Med. 2017 Jun 1;376:2134-2146 (texte complet)
Jacobson IM, Lawitz E, Gane EJ et al. Efficacy of 8 Weeks of Sofosbuvir, Velpatasvir, and Voxilaprevir in Patients With Chronic HCV Infection: 2 Phase 3 Randomized Trials. Gastroenterology. 2017 Jul;153:113-122 (abstract)
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 6 minutes
6 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.