
La tyrosinémie de type I est une maladie héréditaire liée au défaut de catabolisme de la tyrosine (illustration).
Nouvelles présentations d'ORFADIN dans la HT-1
La spécialité hospitalière ORFADIN (nitisinone) est désormais disponible :
- en gélule à 20 mg de principe actif ;
- en suspension buvable à 4 mg/mL de principe actif.
Encadré 1 - La tyrosinémie héréditaire de type 1 en bref (d'après Orphanet)
| La tyrosinémie de type 1 est une maladie du métabolisme des acides aminés caractérisée par une atteinte hépatorénale. La prévalence est estimée à 1 cas sur deux millions. Dans la forme infantile précoce aiguë, l'affection débute entre 15 jours et 3 mois par un syndrome de nécrose hépatocellulaire avec vomissements, diarrhée, ictère, hypoglycémie, oedème, ascite et syndrome hémorragique. Une complication septicémique est fréquente. S'y associent une tubulopathie avec un rachitisme hypophosphatémique. La maladie peut débuter plus tardivement par un rachitisme vitamino-résistant lié à la tubulopathie. Non traitée, la maladie aiguë peut se compliquer de crises tyrosinémiques avec des accès de polynévrite porphyrique et une dystonie qui peuvent exceptionnellement être révélateurs. L'apparition d'hépatomes malins est fréquente. La transmission est autosomique récessive et la maladie est due à un déficit en fumaryl acétoacétase (FAH, 15q23-q25), dans la voie de dégradation de la tyrosine, se traduisant par l'inhibition d'une enzyme clé de la synthèse des porphobilinogènes (la delta amino lévulinate D hydratase). Le diagnostic est confirmé par la mise en évidence de l'acide delta aminolévulinique dans les urines (par dosages spécifiques), la chromatographie en phase gazeuse des urines montre la présence de la succinyl acétone caractéristique, le dosage enzymatique sur fibroblastes est également possible. |
ORFADIN 20 mg gélule et ORFADIN 4 mg/ml suspension buvable ont obtenu leur AMM sur la base de deux études ayant démontré leur bioéquivalence avec les autres présentations en gélule (Cf. avis de la Commission de la transparence du 14 décembre 2016).
Dans son avis précédent (20 juin 2007), la Commission de la transparence avait considéré que le service médical rendu (SMR) d'ORFADIN 2 mg, 5 mg et 10 mg gélules était important et que ces spécialités apportaient, en association à un régime alimentaire à faible teneur en tyrosine et en phénylalanine, une amélioration du SMR importante (ASMR II) par rapport au seul régime alimentaire, dans le traitement de patients atteint de tyrosinémie héréditaire de type 1.
ORFADIN en pratique
La dose quotidienne initiale recommandée d'ORFADIN chez l'adulte et l'enfant est de 1 mg/kg de poids corporel à administrer par voie orale, en 1 prise par jour.
Chez les patients dont le poids est inférieur à 20 kg, il est recommandé de fractionner la dose quotidienne totale en 2 administrations par jour.
Un ajustement de la dose peut être envisagé en fonction du taux urinaire de succinylacétone, sans dépasser la dose maximale journalière de 2 mg/kg.
- ORFADIN gélule
Si nécessaire, la gélule peut être ouverte et son contenu dispersé dans une petite quantité d'eau ou d'aliments juste avant la prise.
Si le traitement est instauré avec de la nourriture, il est recommandé de le poursuivre dans les mêmes conditions
- ORFADIN suspension buvable
Elle est aromatisée à la fraise.
Elle est administrée à l'aide d'une seringue pour administration orale, directement dans la bouche du patient, sans dilution.
Il est recommandé de prendre la suspension buvable au cours des repas.
Ce médicament peut avoir l'aspect d'un agglomérat solide avec un surnageant légèrement opalescent.
Une remise en suspension est donc nécessaire avant chaque utilisation, par une agitation vigoureuse (au moins 20 secondes lors de la première utilisation et 5 secondes les fois suivantes), jusqu'à dispersion complète de l'agglomérat solide.
La dose doit être prélevée et administrée tout de suite après la remise en suspension.
- Comment utiliser les seringues pour administration orale ?
o la seringue de 1 mL (graduée tous les 0,01 mL) à utiliser pour des doses allant de 1 mg (0,25 mL) à 4 mg (1 mL) ;
o la seringue de 3 mL (graduée tous les 0,1 mL) à utiliser pour des doses allant de 4,5 mg (1,1 mL) à 12 mg (3 mL) ;
o la seringue de 5 mL (graduée tous les 0,2 mL) à utiliser pour des doses allant de 13 mg (3,2 mL) à 20 mg (5 mL) (Cf. Tableau I).
Tableau I - Tableaux de conversion des doses d'ORFADIN correspondant aux trois tailles de seringue pour administration orale
Il est recommandé aux professionnels de santé de conseiller le patient ou le soignant sur l'utilisation des seringues pour administration orale pour garantir l'administration du volume correct et de s'assurer que la prescription est donnée en mL.
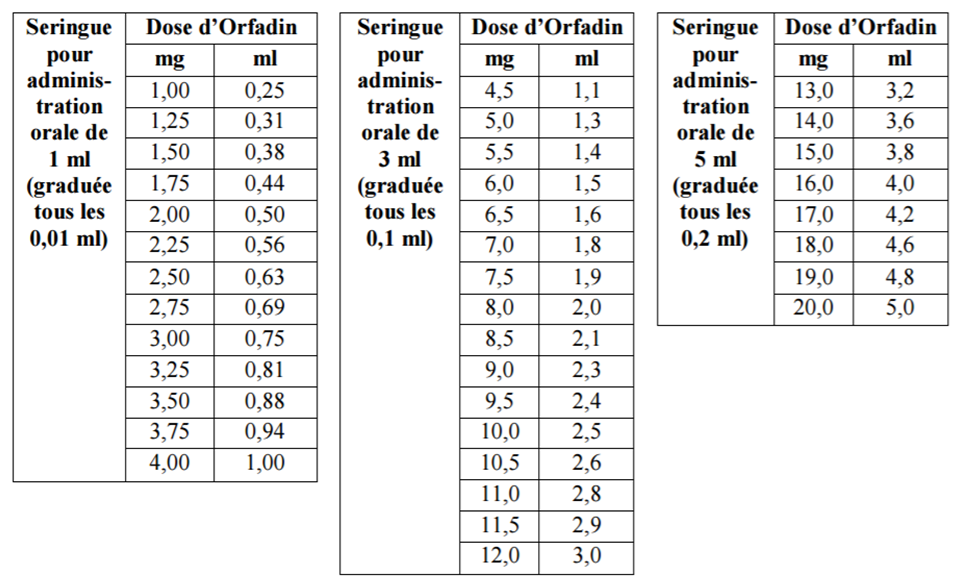
Lors de la première utilisation, l'adaptateur en plastique doit être enfoncé sur le goulot du flacon aussi loin que possible (Cf. Figure 1).
Figure 1 - Comment préparer un flacon neuf de médicament pour la 1re utilisation ?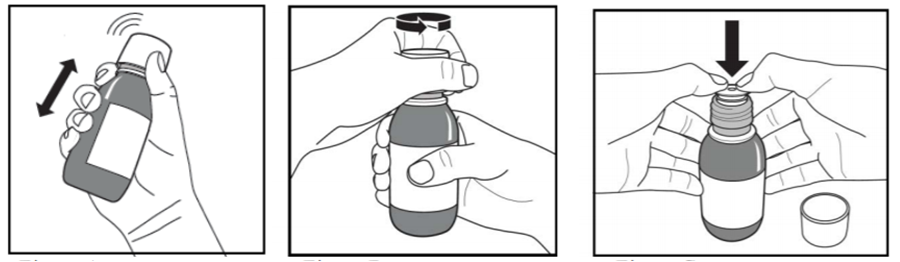

Le prélèvement de la suspension est réalisé avec le flacon positionné tête en bas, la seringue enfoncée dans le trou de l'adaptateur (Cf. Figure 2).
Après chaque utilisation, la seringue doit être immédiatement nettoyée à l'eau, en séparant le corps et le piston.
Figure 2 - Comment préparer une dose d'ORFADIN ?
- Comment conserver la suspension buvable ?
Après la première ouverture, la stabilité en cours d'utilisation est d'une seule période de 2 mois à une température ne dépassant pas 25 °C ; passé ce délai, le produit doit être jeté.
Il est donc important de noter la date de sortie du réfrigérateur sur l'étiquette du flacon lors de la première utilisation.
Identité administrative
- Liste I
- Prescription hospitalière
- ORFADIN 20 mg gélule, flacon de 60, CIP 3400930032572, UCD 3400894195160
- ORFADIN 4 mg/mL suspension buvable, boîte de 1 flacon de 90 mL + 1 adaptateur + 3 seringues pour administration orale, CIP 3400930033913, UCD 3400894195221
- Agrément aux collectivités (Journal officiel du 2 février 2017 - texte 35)
- Inscription sur la liste de rétrocession (Journal officiel du 14 mars 2017 - texte 14 avec prise en charge à 100 % (Journal officiel du 14 juin 2017 - texte 13)
- Prix de vente HT par UCD (Journal officiel du 14 juin 2017 - texte 98)
- Laboratoire Sobi
Pour aller plus loin
Avis de la Commission de la transparence (HAS, 14 décembre 2016)
Avis de la Commission de la transparence (HAS, 20 juin 2007)
Résumé EPAR d'ORFADIN sur le site de l'EMA (mise à jour du 1er février 2017)
Pour aller plus loin
Consultez les monographies VIDAL
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 5 minutes
5 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.