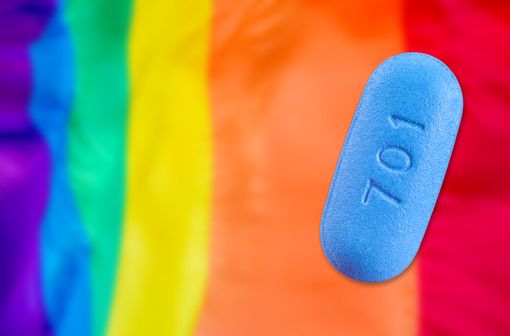
Les comprimés de TRUVADA se présentent sous forme de bâtonnet de couleur bleue portant, sur une face, l'inscription « Gilead », et sur l'autre face, l'inscription « 701 ».
Début d'AMM et fin de RTU
Indiqué dans le traitement de l'infection par le VIH-1, TRUVADA 200 mg/245 mg comprimé pelliculé (emtricitabine, ténofovir disoproxil) a obtenu en août 2016 une extension d'autorisation de mise sur le marché (AMM) dans l'indication en prophylaxie pré-exposition pour réduire le risque d'infection par le VIH-1 (PrEP VIH) par voie sexuelle chez les adultes à haut risque de contamination.
TRUVADA est le seul médicament à disposer d'une indication en PrEP VIH en Europe.
Suite à cette extension d'AMM, la recommandation temporaire d'utilisation (RTU) dont bénéficiait TRUVADA en France depuis janvier 2016 (Cf. notre article du 2 décembre 2015) ne se justifie plus et prendra fin le 28 février 2017.
A ce jour, plus de 3 000 français ont reçu TRUVADA dans le cadre de la RTU.
Une AMM en PrEP VIH basée sur 2 études d'efficacité
L'extension d'indication de TRUVADA en PrEP VIH a été approuvée en juillet 2016 par l'Agence européenne du médicament (EMA) sur la base de 2 études principales :
- l'étude iPrEx (CO-US-104-0288) qui a comparé l'administration de TRUVADA ou d'un placebo chez 2 499 hommes (ou femmes transgenres) non infectés par le VIH, ayant des relations sexuelles avec des hommes et qui ont été considérés comme présentant un haut risque d'acquisition du VIH. Les sujets ont été suivis pendant 4237 personnes-années.
- l'étude Partners PrEP (CO-US-104-0380) ayant comparé l'administration de TRUVADA, du ténofovir disoproxil 245 mg (sous forme de fumarate, VIREAD en France) ou d'un placebo, au sein de couples hétérosexuels sérodiscordants chez 4758 sujets non infectés par le VIH provenant du Kenya et de l'Ouganda. Les sujets ont été suivis pendant 7830 personnes-années.
Les résultats de ces études ont montré une réduction significative du risque relatif d'infection par le VIH-1 avec une prise continue de TRUVADA (Cf. Tableaux I et II).
Tableau I - Efficacité dans l'étude CO-US-104-0288 (iPrEX)
| Placebo | TRUVADA | Valeur de p(a)(b) | |
| Analyse ITTm | |||
| Séroconversions/N | 83/1217 | 48/1224 | 0,002 |
| Réduction du risque relatif (IC à 95 %)(b) | 42 % (18 % ; 60 %) | ||
| RARNP (c) dans les 12 mois précédant la sélection, analyse ITTm | |||
| Séroconversions/N | 72/753 | 34/732 | 0,0349 |
| Réduction du risque relatif (IC à 95 %)(b) | 52 % (28 % ; 68 %) | ||
(a) Valeurs de p par test du log-rank. Les valeurs de p pour les RARNP se réfèrent à l'hypothèse nulle selon laquelle l'efficacité différait entre les catégories de sous-groupes (RARNP, non-RARNP).
(b) Réduction du risque relatif calculé pour la population ITTm d'après la séroconversion incidente, c'est-à-dire survenant après l'inclusion et jusqu'à la première visite post-traitement (environ 1 mois après la dernière dispensation de médicament de l'étude).
(c) Rapport anal réceptif non protégé
(c) Rapport anal réceptif non protégé
Tableau II - Efficacité dans l'étude CO-US-104-0380 (Partners PrEP)
| Placebo | Ténofovir disoproxil 245 mg (sous forme de fumarate) |
TRUVADA | |
| Séroconversions/N(a) | 52/1578 | 17/1579 | 13/1576 |
| Incidence pour 100 personnes- années (IC à 95 %) | 1,99 (1,49 ; 2,62) | 0,65 (0,38 ; 1,05) |
0,50 (0,27 ; 0,85) |
| Réduction du risque relatif (IC à 95 %) |
- | 67 % (44 % ; 81 %) |
75 % (55 % ; 87 %) |
(a) Réduction du risque relatif calculé pour la cohorte ITTm d'après la séroconversion incidente (après l'inclusion). Les comparaisons des groupes recevant le médicament actif sont faites par rapport au placebo.
TRUVADA, un élément de la stratégie de prévention du VIH
Dans son point d'information en date du 20 février 2017, l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) "rappelle que l'utilisation du TRUVADA dans la PrEP VIH s'intègre dans une stratégie de prévention diversifiée de la transmission du VIH par voie sexuelle avec notamment la promotion de l'usage du préservatif, qui protège non seulement du VIH mais également des autres infections sexuellement transmissibles".
En pratique : une extension d'AMM très encadrée
Comme dans le traitement de l'infection par le VIH, la prescription de TRUVADA en PrEP VIH doit être initiée par un médecin spécialiste hospitalier.
Elle peut de plus l'être par un médecin exerçant en CeGIDD (Centre gratuit d'information, de dépistage et de diagnostic des infections par le VIH, les hépatites virales et les infections sexuellement transmissibles) [Cf. notre article du 10 juin 2016].
Le renouvellement de la prescription de TRUVADA, dans la limite d'un an, n'est pas restreint.
- L'observance, condition d'efficacité
Afin de favoriser l'observance (régularité des prises) du traitement PrEP VIH, l'horaire de prise du comprimé devra être déterminé avec le patient de façon à améliorer l'efficacité de TRUVADA.
- Avant d'initier le traitement
- évaluer le risque de contamination du patient ;
- déterminer le statut viral VIH-1 et VHB, ainsi que la présence d'autres infections sexuellement transmissibles (IST). Seuls les patients VIH-séronégatifs et à haut risque peuvent bénéficier d'un traitement prophylactique par TRUVADA ;
- évaluer la fonction rénale : le traitement ne doit pas être initié en cas de clairance inférieure à 60 mL/min, en raison du risque de toxicité rénale du ténofovir disoproxil fumarate. La prise d'AINS à forte dose ou l'association de plusieurs AINS peut majorer le risque rénal ;
- rechercher une grossesse en cours ou prescrire une contraception efficace si ce n'est pas déjà le cas.
En cas d'exposition récente au VIH-1, l'utilisation de TRUVADA doit être retardée de 1 mois.
- Toxicité rénale et séroconversion sous traitement : 2 risques à surveiller étroitement
Par la suite, les principaux risques associés à l'utilisation de TRUVADA seront surveillés au moins tous les 3 mois : la toxicité rénale, la séroconversion sous traitement.
- Séroconversion pendant le traitement : démarche à suivre
Tout signe ou symptôme évocateur d'une primo-infection au VIH doit être recherché lors du renouvellement de la prescription.
Une séroconversion sous traitement peut être associé à l'apparition de mutations de résistance du VIH.
En cas de séroconversion en cours de traitement :
- TRUVADA doit être arrêté immédiatement ;
- un génotypage de résistance au VIH-1 doit être effectué ;
- un traitement antirétroviral à visée thérapeutique doit être instauré rapidement ;
- le médecin doit déclarer la séroconversion et l'infection à VIH (déclaration obligatoire).
Des documents de réduction des risques pour les prescripteurs et pour les patients traités
Un ensemble de documents sont mis à la disposition des prescripteurs et des patients afin :
- de garantir le bon usage de TRUVADA en PrEP : alerter sur le risque de toxicité rénale liés au tenofovir disoproxil fumarate, sensibiliser à la surveillance du patient pendant le traitement (fonction rénale) ;
- de rappeler les limites du traitement PrEP et l'importance d'associer des mesures de prévention comme l'usage du préservatif ;
- de préciser la démarche à suivre pour contrôler le risque de séroconversion sous traitement ;
- d'accompagner la relation prescripteur/patient et la relation prescripteur/médecin généraliste.
 |
En pratique, le prescripteur peut s'appuyer sur les documents suivants :
Pour le patient, une brochure d'information sur la PrEP et une carte de rappel des modalités de prise du médicament et des rendez-vous ont été élaborées. Ces documents doivent être remis au patient par le prescripteur. |
Prise en charge de TRUVADA en PrEP
Jusqu'à présent, une prise en charge était accordée pour l'utilisation de TRUVADA en PrEP dans le cadre de la RTU.
Contacté par VIDAL, le laboratoire Gilead a indiqué que la prise en charge de TRUVADA est maintenue en relais de la RTU jusqu'au 17 mars prochain.
Dans son autre indication, en traitement de l'infection par le VIH-1 chez l'adulte en association avec d'autres antirétroviraux (Cf. VIDAL Reco "Infection par le VIH"), TRUVADA est pris en charge à 100 % par l'Assurance maldie et agréé aux collectivités.
Son prix de vente (hors honoraire de dispensation) s'élève à 406,87 euros (30 comprimés).
Pour aller plus loin
Truvada dans la prophylaxie Pré-exposition (PrEP) au VIH : fin de la Recommandation Temporaire d'Utilisation - Point d'information (ANSM, 20 février 2017)
First medicine for HIV pre-exposure prophylaxis recommended for approval in the EU (EMA, 22 juillet 2016)
Documents de réduction des risques
Informations importantes concernant le bon usage de TRUVADA dans l'indication « Prophylaxie pré-exposition (PrEP) » au VIH - Brochure destinée aux prescripteurs (20 février 2017)
Check-list pour le médecin prescripteur (20 février 2017)
Courrier de liaison entre le prescripteur initial et le médecin généraliste, en cas de renouvellement de la prescription par ce dernier (20 février 2017)
Déclaration d'une séroconversion VIH au cours d'un traitement par TRUVADA dans le cadre d'une prophylaxie pré-exposition au VIH (PrEP) (20 février 2017)
Informations importantes concernant le bon usage de TRUVADA dans l'indication « Prophylaxie pré-exposition (PrEP) » au VIH - Brochure destinée aux patients (20 février 2017)
Carte de rappel des prises et des rendez-vous (20 février 2017)
Sur VIDAL.fr
Prophylaxie pré-exposition contre le VIH (PReP) : prescription désormais ouverte aux médecins des CeGIDD (10 juin 2016)
Prophylaxie pré-exposition contre le VIH/sida : la RTU de TRUVADA établie par l'ANSM (2 décembre 2015)
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 7 minutes
7 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.