Le cancer de la thyroïde représente 1 % de l'ensemble des cancers, son incidence est en augmentation en France (illustration).
Nouveau principe actif inhibiteur des RTK dans la prise en charge du carcinome thyroïdien différencié
LENVIMA gélule est un nouvel antinéoplasique de la classe des inhibiteurs des récepteurs tyrosine kinase (RTK).
Son principe actif, le lenvatinib, est une nouvelle substance qui agit en inhibant de façon sélective les activités kinases des récepteurs du facteur de croissance de l'endothélium vasculaire (VEGF) ainsi que d'autres RTK liés aux voies proangiogéniques et oncogéniques.
LENVIMA est indiqué dans le traitement des patients adultes atteints de carcinome thyroïdien différencié (papillaire, folliculaire, à cellules de Hürthle) localement avancé ou métastatique, réfractaire à l'iode radioactif (IRA) et progressif.
D'avril à septembre 2015, LENVIMA a été disponible en France en ATU (autorisation temporaire d'utilisation) de cohorte dans le traitement des patients présentant un cancer différencié de la thyroïde réfractaire à l'iode radioactif en progression. Une AMM (autorisation de mise sur le marché) européenne lui a été octroyée en mai 2015.
Un gain absolu de 14,7 mois en termes de survie sans progression
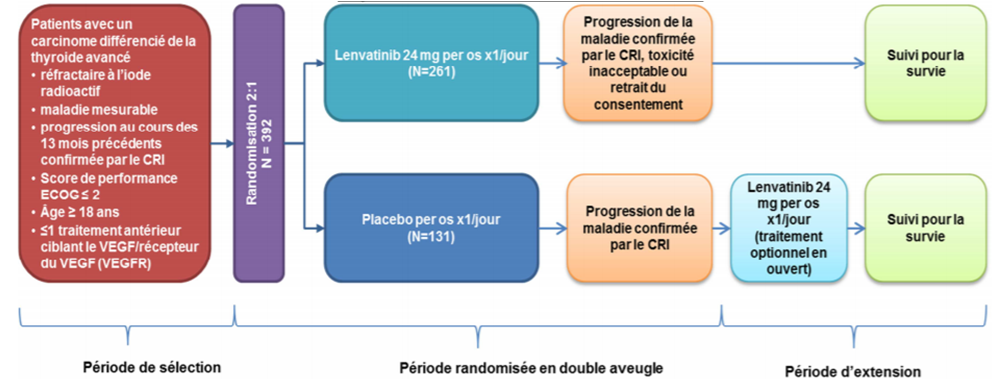
Dans son avis du 2 décembre 2015, la Commission de la transparence a évalué l'efficacité et la tolérance de LENVIMA sur la base des résultats de l'étude pivot SELECT, un essai de phase III, randomisé en double aveugle versus placebo, mené auprès de 392 patients ayant un cancer différencié de la thyroïde, principalement métastatique, en progression dans les 12 mois précédent l'inclusion et réfractaire à l'iode radioactif ou en progression malgré un traitement à l'iode 131.
Le schéma de l'étude comportait 3 périodes (Cf. Figure 1).
Figure 1 - Schéma de l'étude SELECT
 |
CRI : comité de relecture indépendant
Près d'1/4 des patients avait été traité antérieurement par un traitement ciblant le VEGF/VEGFR, principalement par NEXAVAR (sorafénib) [Cf. notre article du 10 novembre 2015].
La dose de LENVIMA administrée par voie orale était de 24 mg 1 fois par jour.
La médiane de survie sans progression (critère de jugement principal) a été de 18,3 mois dans le groupe LENVIMA versus 3,6 mois dans le groupe placebo, soit un gain en valeur absolu de 14,7 mois en faveur de LENVIMA (HR=0,21 ; IC95% [0,14 - 0,31] ; p<0,0001).
Concernant les critères de jugement secondaires, le pourcentage de réponse globale (réponse complète + partielle) a été de 64,8 % (dont 1,5 % de rponse complète) dans le groupe LENVIMA versus 1,5 % dans le groupe placebo (dont 1 réponse complète) [p < 0,0001].
La survie globale n'a pas été différente entre LENVIMA et le placebo lors de l'analyse principale (la médiane de survie globale n'a pas été atteinte dans les 2 goupes).
On ne dispose pas d'étude comparative versus NEXAVAR (sorafénib), qui est le comparateur cliniquement pertinent mais dont le développement a été concomitant à celui de LENVIMA.
Des événements indésirables plus fréquents et plus graves
En termes de tolérance, les arrêts de traitement pour événements indésirables (EI) ont concerné 16,5 % des patients du groupe LENVIMA versus 4,6 % des patients du groupe placebo. La moitié des patients sous LENVIMA a présenté au moins un EI grave et environ 72 % ont présenté des EI de grade 3.
Les EI plus fréquents ont été une hypertension artérielle, une perte de poids, une protéinurie et une diarrhée.
Des EI d'issue fatale ont été rapportés chez 20 patients du groupe LENVIMA (8 %) ; six d'entre eux étaient considérés comme liés au traitement.
Au cours de l'étude SELECT, la posologie de LENVIMA a été réduite chez 78,5 % des patients.
Le laboratoire s'est engagé à réaliser une étude pour évaluer l'efficacité et la tolérance de LENVIMA à une dose d'instauration inférieure à la dose recommandée dans le RCP (résumé des caractéristiques du produit).
Dans cette attente, la posologie optimale de LENVIMA reste à déterminer.
SMR important et ASMR mineure
Au vu de l'ensemble des données disponibles, la Commission de la transparence (CT) a attribué un SMR (service médical rendu) important à LENVIMA.
Considérant l'absence de démonstration de gain en survie globale et de données de qualité de vie, ainsi qu'une toxicité préoccupante, mais tenant compte de l'allongement de la médiane de survie sans progression (+ 14,7 mois) chez les patients à un stade avancé de la maladie, la CT a considéré que LENVIMA apporte une amélioration du SMR mineure (ASMR IV) en termes d'efficacité.
La Commission place LENVIMA dans la stratégie thérapeutique comme :
- une alternative à NEXAVAR (sorafénib), en première intention, dans la prise en charge du cancer différencié de la thyroïde au stade localement avancé non opérable ou métastatique, réfractaire à l'iode radioactif, en progression, chez des patients sélectionnés ;
- une option thérapeutique chez les patients réfractaires à l'iode radioactif et en échec à NEXAVAR.
LENVIMA : en pratique
Le traitement par LENVIMA doit être instauré et supervisé par un médecin expérimenté dans l'utilisation des traitements anticancéreux.
LENVIMA se présente sous forme de gélules dosées à 4 mg et à 10 mg de lenvatinib.
La dose quotidienne recommandée de lenvatinib est de 24 mg 1 fois par jour, soit 2 gélules de 10 mg et 1 gélule de 4 mg.
La dose doit être administrée à peu près à la même heure chaque jour, au cours ou en dehors des repas. Il ne faut pas ouvrir la gélule.
Le traitement sera poursuivi aussi longtemps qu'un bénéfice clinique est observé ou jusqu'à la survenue d'une toxicité inacceptable.
- En cas d'effets indésirables
Avant toute interruption de traitement ou réduction de la dose, un traitement médical optimal des nausées, des vomissements et de la diarrhée doit être instauré.
La toxicité gastro-intestinale doit être traitée activement afin de réduire le risque de développement d'une atteinte ou d'une insuffisance rénale.
En cas d'effets indésirables sévères (par exemple de grade 3) ou intolérables, le traitement par LENVIMA doit être interrompu jusqu'à résolution ou régression de l'EI ; le traitement sera ensuite repris à dose réduite (Cf. Tableau I).
Tableau I - Modifications de la dose recommandée de LENVIMA
| Palier de dose | Dose quotidienne | Nombre de gélules |
| Dose quotidienne recommandée | 24 mg par voie orale une fois par jour | Deux gélules de 10 mg + une gélule de 4 mg |
| Première réduction de dose | 20 mg par voie orale une fois par jour | Deux gélules de 10 mg |
| Deuxième réduction de dose | 14 mg par voie orale une fois par jour | Une gélule de 10 mg + une gélule de 4 mg |
| Troisième réduction de dose | 10 mg par voie orale une fois par jour (a) | Une gélule de 10 mg |
- Surveillance particulière
en prévention notamment des EI suivants :
- hypertension artérielle : contrôle de la pression artérielle avant l'instauration, puis contrôle 1 semaine après l'instauration du traitement, puis toutes les 2 semaines les 2 premiers mois, puis 1 fois par mois ;
- protéinurie : contrôle régulier des protéines urinaires ;
- diarrhée : prévenir la déshydratation ;
- altération de la fonction cardiaque : surveillance cardiaque régulière ;
- syndrome d'encéphalopathie postérieure réversible (SEPR)/Syndrome de - leucoencéphalopathie postérieure réversible (SLPR) : surveillance des signes cliniques tels que céphalées, convulsions, léthargie, confusion, altération de l'état mental, cécité et autres troubles visuels ou neurologiques ;
- hépatotoxicité : bilan hépatique avant l'instauration du traitement, puis toutes les 2 semaines pendant les 2 premiers mois de traitement, puis 1 fois par mois ;
- événements hémorragiques : surveillance de saignements tumoraux, ou d'hémorragies intra-crâniennes ;
- allongement de l'intervalle QT : surveillance de l'ECG et des électrolytes (K, Mg, Ca) avant et pendant le traitement.
Chez les femmes en âge de procréer, une méthode hautement efficace de contraception doit être utilisée pendant le traitement par LENVIMA et 1 mois après son arrêt.
LENVIMA fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité (Cf. Infos Pratiques VIDAL - Médicaments sous surveillance renforcée). Les professionnels de santé déclarent tout effet indésirable suspecté (Cf. ANSM - Comment déclarer un effet indésirable ?).
Identité administrative
- Liste I
- Prescription hospitalière, réservée aux spécialistes en oncologie ou aux médecins compétents en cancérologie
- Surveillance particulière pendant le traitement
- LENVIMA 4 mg, boîte de 30 gélules, CIP 3400930018941
- LENVIMA 10 mg, boîte de 30 gélules, CIP 3400930018958
- Remboursable à 100 % (Journal officiel du 10 janvier 2017 - texte 17)
- Prix public TTC = 1 719,28 euros
- Agrément aux collectivités (Journal officiel du 10 janvier 2017 - texte 18)
- Laboratoire Eisai
Pour aller plus loin
Avis de la Commission de la transparence (HAS, 2 décembre 2015)
Pour aller plus loin
Consultez les monographies VIDAL
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 7 minutes
7 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.