
La BPCO entraîne un handicap, une dégradation marquée de la qualité de vie et peut engager le pronostic vital (illustration).
Une nouvelle association fixe de 2 bronchodilatateurs dans la prise en charge de la BPCO
ANORO 55 µg/22 µg poudre pour inhalation en récipient unidose est une nouvelle association fixe d'un agoniste bêta-2-adrénergique de longue durée d'action (LABA), le vilantérol, et d'un anticholinergique de longue durée d'action (LAMA), l'uméclidinium, indiquée en traitement bronchodilatateur continu pour soulager les symptômes chez les patients adultes présentant une bronchopneumopathie chronique obstructive (BPCO) [Cf. VIDAL Reco "BPCO"].
Pour rappel, le vilantérol entre dans la composition RELVAR ELLIPTA, en association fixe avec la fluticasone, indiqué dans la prise en charge de l'asthme et de la BPCO (Cf. notre article du 17 juin 2015), et l'uméclidinium est le principe actif d'INCRUSE, indiqué dans la prise en charge de la BPCO (Cf. notre article du 8 avril 2016).
ANORO évalué par la CT sur la base de 9 études
L'efficacité et la tolérance d'ANORO ont été évaluées par la Commission de la transparence (CT) sur la base de 9 essais (Cf. Avis du 7 septembre 2016), dont :
- 4 incluaient un bras placebo et étudiaient, pour deux d'entre elles, l'amélioration de la fonction respiratoire à 24 semaines (études pivots DB2113373 et DB2113361) et, pour les deux autres, la tolérance à l'effort à 12 semaines (études DB2114417 et DB2114418) ;
- 5 étaient menées versus comparateur actif dont trois versus tiotropium seul, un LAMA (2 études pivots DB 2113360 et DB2113374, et l'étude ZEP117115), une étude versus l'association libre LABA + LAMA, indacatérol et tiotropium (étude DB2116961) et une étude "d'escalade thérapeutique" versus tiotropium (étude 116960).
- Efficacité sur la fonction respiratoire
Les résultats ont été plus hétérogènes versus principes actifs (tiotropium, uméclidinum, vilantérol).
ANORO a été non inférieure à l'association libre indacatérol + tiotropium après 12 semaines de traitement.
- Efficacité sur la dyspnée
Versus les principes actifs pris séparément ou le tiotropium, les améliorations du score TDI n'ont pas été statistiquement significatives.
- Efficacité sur la qualité de vie
- Tolérance
Un traitement de seconde intention dans la stratégie thérapeutique de la BPCO
Au vu des résultats de ces études, la Commission de la transparence considère que la démonstration de l'efficacité d'ANORO sur le VEMS résiduel, les symptômes de dyspnée, la diminution des exacerbations et la qualité de vie n'est pas claire par rapport à un LABA ou un LAMA pris seul.
A ce titre, elle juge que l'intérêt clinique d'ANORO est faible et que sa place dans la stratégie thérapeutique est celle d'un médicament de seconde intention chez les patients atteints de BPCO modérée à sévère en cas de réponse insuffisante à un bronchodilatateur de longue durée d'action en monothérapie (Cf. Figure 1).
La Commission recommande de ne pas poursuivre un traitement par une association de bronchodilatateurs LABA/LAMA en l'absence de bénéfices pour le patient.
Figure 1 - Stratégie thérapeutique dans la BPCO en fonction de la sévérité (SPLF 2009)
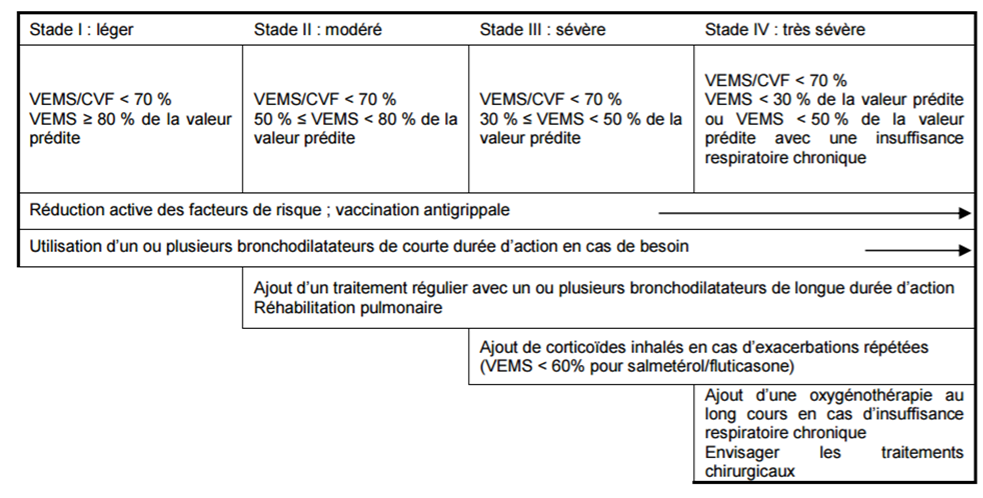
Le SMR (service médical rendu) d'ANORO est considéré comme modéré dans l'indication de son autorisation de mise sur le marché (AMM) et l'amélioration du SMR (ASMR) de niveau V (absence).
ANORO fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité (Cf. Infos Pratiques VIDAL - Médicaments sous surveillance renforcée). Les professionnels de santé déclarent tout effet indésirable suspecté (Cf. ANSM - Comment déclarer un effet indésirable ?).
Administration d'ANORO avec l'inhalateur ELLIPTA
Le dispositif d'inhalation d'ANORO est un inhalateur ELLIPTA.
Il contient 30 doses et permet de délivrer 55 µg d'uméclidinium et 22 µg de vilantérol par dose.
 L'inhalateur ELLIPTA est prêt à l'emploi. Il est muni d'un couvercle rouge et d'un compteur de doses (de 30 à 0 au fil des inhalations).
L'inhalateur ELLIPTA est prêt à l'emploi. Il est muni d'un couvercle rouge et d'un compteur de doses (de 30 à 0 au fil des inhalations).L'ouverture du couvercle déclenche la libération d'une dose. C'est pourquoi le couvercle ne sera ouvert que lorsque le patient est prêt à prendre une dose.
Lorsqu'il reste moins de 10 doses, la moitié du compteur devient rouge.
L'inhalateur ne doit pas être utilisé au-delà de 6 semaines après l'ouverture de la barquette dans laquelle il est conditionné.
Utilisation d'ANORO : posologie et manipulation
Chez l'adulte, la dose recommandée d'ANORO est de 1 inhalation 1 fois par jour (qui correspond aussi à la dose maximale journalière).
L'inhalation doit être réalisée tous les jours à la même heure, afin de maintenir la bronchodilatation.
- Instructions d'utilisation d'ANORO pour les patients

Lorsque le patient est prêt pour l'inhalation, il doit ouvrir le couvercle de l'inhalateur (faire glisser vers le bas) jusqu'à entendre un « clic ».
Le médicament est prêt à être inhalé et le compteur de dose affiche une dose en moins pour le confirmer.
Si l'inhalateur ne commence pas le décompte des doses dès le « clic », il ne délivrera pas de dose et devra être rapporté au pharmacien.
Avant de prendre la dose, le patient doit expirer autant que possible (pas dans l'inhalateur).
Il doit ensuite serrer fermement les lèvres autour de l'embout buccal, inspirer profondément et régulièrement, puis retenir son souffle aussi longtemps que possible (pendant au moins 3-4 secondes).
Lors de l'inhalation, la grille d'aération ne doit pas être bloquée avec les doigts.
Après avoir retiré l'inhalateur de la bouche, il est recommandé d'expirer lentement et doucement.
Conseils et recommandations aux patients
ANORO ne doit pas être utilisé chez les patients présentant un asthme (absence d'étude).
Le couvercle ne doit être ouvert que si le patient est prêt à prendre la dose.
- Date de limite d'utilisation
Autrement dit, l'inhalateur ne doit plus être utilisé au-delà de 6 semaines après l'ouverture de la barquette. La barquette peut être jetée dès sa première ouverture.
- Pour s'assurer de la prise
Même en cas d'utilisation correcte, il est possible de ne ressentir ni le produit ni son goût.
Si le compteur de doses est passé au nombre inférieur, la dose a été délivrée.
- Après l'utilisation
Le couvercle doit être remonté jusqu'à ce qu'il couvre l'embout buccal.
Identité administrative
- Liste I
- Boîte de 1 inhalateur (Ellipta) de 30 doses, CIP 3400930004593
- Remboursable à 30 % (Journal officiel du 10 janvier 2017 - texte 17)
- Prix public TTC = 46,98 euros
- Agrément aux collectivités (Journal officiel du 10 janvier 2017 - texte 18)
- Laboratoire GlaxoSmithKline
Pour aller plus loin
Avis de la Commission de la transparence (HAS, 7 septembre 2016)
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 6 minutes
6 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.