Représentation en 3D d'imunoglobulines humaines (illustration).
HYQVIA nouvelle Ig humaine normale SC en une seule perfusion toutes le 3 à 4 semaines
HYQVIA 100 mg/mL solution pour perfusion SC (sous-cutanée) est une nouvelle spécialité d'immunoglobuline (Ig) humaine normale (Cf. VIDAL Reco "Immunoglobulines humaines polyvalentes (traitement par)"), indiquée dans le traitement substitutif chez l'adulte, l'enfant et l'adolescent (âgé de 0 à 18 ans) atteints :
- de déficits immunitaires primitifs (DIP) avec production défaillante d'anticorps ;
- d'hypogammaglobulinémie et infections bactériennes récurrentes :
- chez des patients atteints de leucémie lymphoïde chronique (LLC), chez qui les antibiotiques prophylactiques n'ont pas fonctionné ou sont contre-indiqués ;
- chez des patients atteints de myélome multiple ;
- d'hypogammaglobulinémie chez des patients avant ou après une transplantation de cellules souches hématopoïétiques allogènes.
HYQVIA se compose de deux flacons, un flacon d'immunoglobuline à 10 % et un flacon de hyaluronidase humaine recombinante (rHuPH20), en quantités respectivement appropriées selon les 5 présentations disponibles (Cf. Tableau I).
Tableau I - Composition des différentes présentations HYQVIA
| Hyaluronidase humaine recombinante | Immunoglobuline humaine normale à 10 % | |
| Volume (mL) | Protéines (grammes) | Volume (mL) |
| 1,25 | 2,5 | 25 |
| 2,5 | 5 | 50 |
| 5 | 10 | 100 |
| 10 | 20 | 200 |
| 15 | 30 | 300 |
L'Ig à 10 %, essentiellement composée d'immunoglobulines de type G (IgG), est responsable de l'effet thérapeutique d'HYQVIA.
La hyaluronidase humaine recombinante, une forme recombinante et soluble de la hyaluronidase humaine, a pour rôle de faciliter l'absorption de l'Ig à 10 %, par modification de la perméabilité du tissu conjonctif (hydrolyse de l'acide hyaluronique tissulaire).
Ces 2 composants ne doivent pas être mélangés : ils doivent être administrés successivement à l'aide d'une pompe à perfusion à débit variable avec la même aiguille, en commençant par la hyaluronidase humaine recombinante, suivie de l'Ig à 10 %.
Cette association permet d'administrer HYQVIA en une seule perfusion SC toutes le 3 à 4 semaine.
HYQVIA : une alternative aux autres Ig humaines normales par voie IV ou SC
Dans son avis du 16 septembre 2015, la Commission de la transparence s'est appuyée sur une étude de phase III multicentrique non comparative (Wasserman RL et coll. J Allergy Clin Immunol 2012) pour évaluer l'efficacité et la tolérance d'HYQVIA (IgHy) chez patients atteints de DIP (n = 83), prétraités par une Ig humaine normale soit par voir intraveineuse (IgIV) administrée toutes les 3 à 4 semaines (n = 56), soit par voie sous cutanée (IgSC) administrée chaque semaine (n = 31) [Cf. Figure 1].
Figure 1 - Protocole de l'étude pivot Wasserman RL et coll. J Allergy Clin Immunol 2012
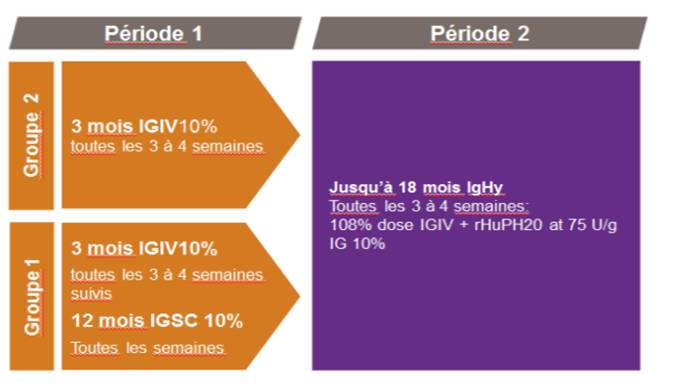
Les données issues de la période 1 ont été comparées à celles de la période 2 afin d'évaluer les profils pharmacocinétiques, la sécurité et la tolérance d'HYQVIA par rapport à l'IgIV et à l'IgSC.
Le critère de jugement principal était le taux annuel d'infections bactériennes graves (bactériémie/septicémie, méningite bactérienne, ostéomyélite/arthrite septique, pneumonie bactérienne et abcès viscéral, causés par des bactéries pathogènes identifiées) développées par les patients au cours du traitement.
Les résultas ont montré que ce taux a été de 0,025 lors du traitement par HYQVIA (survenue de 2 pneumonies bactériennes graves aiguës), soit une valeur inférieure au seuil de 1 prédéfini (p < 0,0001, limite supérieure de l'IC99 % unilatéral = 0,046).
S'agissant de la qualité de vie, les scores médians ont été comparables dans les 3 groupes de traitement (IgSC, IgIV et IgHy).
Lors de la phase d'extension sur 3 ans de cette étude (étude 160902), le taux d'infections toutes causes confondues a été stable (2,25, 3,36 et 2,33).
En termes de tolérance, les effets indésirables principalement observés étaient de nature systémique, dont des maux de tête (taux par injection = 0,031), de la fatigue (0,012), des nausées (0,010), de la fièvre (0,009), des vomissements (0,008) et des frissons (0,003).
La Commission indique que pour évaluer le profil d'immunogénicité de l'administration SC de hyaluronidase humaine recombinante (anticorps anti-rHuPH20), des données de suivi à plus long terme seront nécessaires.
Au vu de l'ensemble des données disponibles, la Commission considère que HYQVIA occupe la même place que les autres spécialités à base d'immunoglobulines humaines normales (par voie IV ou SC) dans la stratégie thérapeutique des DI primitifs et secondaires.
HYQVIA constitue "une alternative thérapeutique supplémentaire qui permet une administration SC mensuelle en un site unique (par rapport aux IgIV administrées en un site de façon mensuelle et par rapport aux IgSC administrées en plusieurs sites de façon hebdomadaire)".
La Commission précise qu'en l'absence de données comparatives directes versus les autres immunoglobulines (IV ou SC) et de données dans les DI secondaires et en instauration de traitement dans les DIP, le choix d'une Ig par rapport à une autre ne peut être précisé.
Un SMR important a été accordé à HYQVIA dans le traitement substitutif chez l'adulte atteint de déficits immunitaires primitifs et en cas de myélome ou LLC avec hypogammaglobulinémie secondaire sévère et infections récurrentes.
HYQVIA en pratique
Le traitement substitutif par HYQVIA doit être instauré et surveillé par un médecin expérimenté dans la prise en charge des déficits immunitaires.
HYQVIA peut servir à administrer une thérapeutique complète sur un ou deux sites jusqu'à toute les quatre semaines. La fréquence et le nombre de sites de perfusion seront réglés en tenant compte du volume, du temps total de perfusion et de la tolérance, de manière à ce que le patient reçoive la même dose équivalente par semaine.
La posologie et le schéma posologique dépendent de l'indication thérapeutique (Cf. Monographie VIDAL de HYQVIA - Posologie et mode d'administration).
Les deux composants d'HYQVIA doivent être perfusés à l'aide d'une pompe à perfusion à débit variable, uniquement par voie sous-cutanée. Les sites recommandés pour la perfusion du médicament sont la partie supérieure et moyenne de l'abdomen et la cuisse.
- Utilisation à l'hôpital ou à domicile
- instauration et surveillance du traitement par un médecin expérimenté dans l'encadrement des patients traités à domicile,
- formation du patient aux techniques de perfusion, à l'utilisation d'une pompe à perfusion ou d'un pousse-seringue,
- tenue d'un carnet de traitement,
- formation du patient à la reconnaissance d'effets indésirables sévères (hypersensibilité, inflammation chronique, nodule ou inflammation au site de perfusion, signes de thrombo-embolie, syndrome de méningite aseptique) et aux mesures à prendre en cas d'apparition de ceux-ci.
HYQVIA doit être conservé au réfrigérateur, entre 2 °C et 8 °C, dans son emballage extérieur à l'abri de la lumière.
Avant d'utiliser HYQVIA, le produit doit être amené à température ambiante.
- Des précautions d'emploi visant à limiter les effets indésirables
Les complications peuvent souvent être évitées :
- en commençant par administrer le produit lentement par perfusion ;
- en assurant une surveillance étroite pendant toute la durée de la perfusion afin de détecter d'éventuels signes d'intolérance lors de la première administration d'une immunoglobuline humaine normale, lors d'un changement d'immunoglobuline humaine normale ou en cas d'interruption prolongée du traitement, le patient doit être maintenu sous surveillance pendant toute la durée de la première perfusion et pendant l'heure qui suit la fin de l'injection.
Tous les autres patients devront être maintenus en observation pendant au moins 20 minutes après la fin de la perfusion.
En cas d'administration à domicile, une autre personne responsable doit être à disposition pour traiter les éventuels effets indésirables ou demander de l'aide en cas d'effet indésirable grave.
En cas d'effet indésirable, le débit d'administration doit être réduit ou la perfusion interrompue.
Comme pour tous les médicaments dont les autorités sanitaires souhaitent pouvoir disposer de données complémentaires, MEKINIST fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité (Cf. Infos Pratiques VIDAL - Médicaments sous surveillance renforcée).
Dans ce contexte, les professionnels de santé sont invités à déclarer tout effet indésirable suspecté (Cf. ANSM - Comment déclarer un effet indésirable ?).
Identité administrative
- Liste I
- Prescription hospitalière. La prescription par un médecin exerçant dans un établissement de transfusion sanguine autorisé à dispenser des médicaments aux malades qui y sont traités est également autorisée.
- Boîte de 1 flacon de 25 mL d'Ig + 1 flacon de 1,25 mL de hyaluronidase humaine recombinante, CIP 3400955004219
- Boîte de 1 flacon de 50 mL d'Ig + 1 flacon de 2,5 mL de hyaluronidase humaine recombinante, CIP 3400955004226
- Boîte de 1 flacon de 100 mL d'Ig + 1 flacon de 5 mL de hyaluronidase humaine recombinante, CIP 3400955004233
- Boîte de 1 flacon de 200 mL d'Ig + 1 flacon de 10 mL de hyaluronidase humaine recombinante, CIP 3400955004240
- Boîte de 1 flacon de 300 mL d'Ig + 1 flacon de 15 mL de hyaluronidase humaine recombinante, CIP 3400955004257
- Agrément aux collectivités uniquement chez l'adulte (Journal officiel du 25 octobre 2016 - texte 22)
- Prise en charge en sus des GHS uniquement chez l'adulte (Journal officiel du 25 octobre 2016 - texte 23)
- Inscrit sur la liste de rétrocession avec prise en charge à 100 % uniquement chez l'adulte (Journal officiel du 1er décembre 2016 - texte 21)
- Laboratoire Baxalta France
Pour aller plus loin
Avis de la Commission de la Transparence (HAS, 16 septembre 2015)
Sur VIDAL.fr
Immunoglobulines polyvalentes humaines : remise à disposition de toutes les spécialités (14 novembre 2016)
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Pour recevoir gratuitement toute lãactualitûˋ par mail Je m'abonne !

 7 minutes
7 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.