Injection intracytoplasmique d'un spermatozoïde dans un ovule retenu par une pipette de succion (illustration).
OVALEAP : nouveau biosimilaire de GONAL-F
OVALEAP (follitropine alfa) est un médicament biosimilaire de GONAL-F avec lequel il partage les mêmes indications :
- chez les femmes adultes :
- anovulation (y compris le syndrome des ovaires polykystiques) chez les femmes qui n'ont pas répondu au traitement par le citrate de clomifène ;
- stimulation de la croissance folliculaire multiple, chez les femmes entreprenant une superovulation dans le cadre des techniques d'assistance médicale à la procréation (AMP) telles que la fécondation in vitro (FIV), le transfert intratubaire de gamètes et le transfert intratubaire de zygotes ;
- en association avec une préparation d'hormone lutéinisante (LH), OVALEAP est recommandé pour stimuler le développement folliculaire chez les femmes qui présentent un déficit sévère en LH et en FSH. Au cours des essais cliniques, ces patientes étaient définies par un taux plasmatique de LH endogène < 1,2 UI/L ;
- chez les hommes adultes : stimulation de la spermatogenèse chez les hommes atteints d'hypogonadisme hypogonadotrophique, congénital ou acquis, en association avec la choriogonadotropine humaine (hCG).
Biosimilarité entre OVALEAP et GONAL-F : les études à l'appui de l'AMM
L'autorisation de mise sur le marché (AMM) européenne d'OVALEAP a été octroyée sur la base de plusieurs études dont :
- une étude de bioéquivalence pharmacocinétique (XM17-02) par rapport au médicament de référence GONAL-F, lors de l'administration d'une dose unique de 300 UI ;
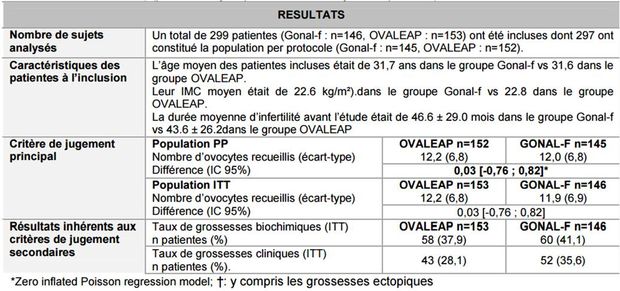
- d'une étude d'efficacité/tolérance de phase III (XM17-05) multicentrique, contrôlée, randomisée, en simple aveugle, comparative entre OVALEAP (n = 153) et GONAL-F (n = 146), dans la stimulation de la croissance folliculaire multiple. Le critère de jugement principal d'efficacité était le nombre d'ovocytes recueillis. Les résultats sont présentés dans le tableau I ci-dessous.
Tableau I - Résultats de l'étude XM17-05 (extrait de l'avis de la Commission de la transparence)
Les résultats de ces études ont permis de conclure à la biosimilarité entre OVALEAP et GONAL-F (voir l'avis de la Commission de la transparence du 25 novembre 2015).
Une tolérance "similaire dans son ensemble"
En termes de tolérance, la fréquence des effets indésirables a été similaire dans son ensemble entre les 2 groupes de traitement de l'étude de phase III (16,3 % vs 15,1 % respectivement pour OVALEAP et GONAL-F : voir Tableau II).
Tableau II - Effets indésirables les plus fréquents dans l'étude de phase III XM17-05
| EI les plus fréquents | OVALEAP (n=153) | GONAL-f (n=146) |
| Hyperstimulation ovarienne – n patientes (%) | 7 (4,6) | 4 (2,7) |
| Douleur abdominale – n patientes (%) | 5 (3,3) | 1 (0,7) |
| Avortement avec rétention – n patientes (%)* | 0 | 3 (2,1) |
| Grossesse extra-utérine† – n patientes (%) | 2 (1,3) | 1 (0,7) |
| Nausée – n patientes (%) | 2 (1,3) | 1 (0,7) |
| Hémorragie – n patientes (%) | 1 (0,7) | 1 (0,7) |
| Céphalée – n patientes (%) | 2 (1,3) | 0 |
† : événements indésirables graves non liés au traitement.
Les événements indésirables liés au traitement ont été plus fréquents dans le groupe OVALEAP (7,2 %) que dans le groupe GONAL-F (3,4 %) et se répartissent de la façon suivante (tableau III) :
Tableau III - Effets indésirables considérés comme liés au traitement
dans l'étude de phase III XM17-05
dans l'étude de phase III XM17-05
| EI considérés comme liés au traitement | OVALEAP (n=153) | GONAL-f (n=146) |
| Hyperstimulation ovarienne – n* patientes (%) | 7 (4,6) | 4 (2,7) |
| Douleur abdominale/abdominale haute/basse – n patientes (%) | 4 (2,7) | 1 (0,7) |
| Nausée – n patientes (%) | 1 (0,7) | 0 |
Concernant les anticorps anti-FSH, tous les prélèvements ont été négatifs au 1er dosage ou au dosage de contrôle en cas de 1er contrôle positif.
OVALEAP fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
Le plan de gestion des risques d'OVALEAP prévoit par ailleurs des mesures complémentaires à la pharmacovigilance de routine concernant les risques d'hyperstimulation ovarienne et d'immunogénicité.
OVALEAP : même place que GONAL-F dans la stratégie de prise en charge de l'infertilité
Dans son avis du 25 novembre 2015, la Commission de la transparence place OVALEAP dans la stratégie thérapeutique de prise en charge de l'infertilité comme un traitement de 1re intention dans toutes ses indications, sauf chez les patientes anovulatoires (y compris le syndrome des ovaires polykystiques) où ce traitement est de 2e intention après échec ou intolérance au citrate de clominofène.
Un service médical rendu (SMR) important a été attribué à OVALEAP dans toutes ses indications mais sans amélioration du SMR (ASMR V) par rapport à la biothérapie de référence, GONAL-F.
OVALEAP : en pratique
OVALEAP est présenté en cartouches multidoses sous 3 dosages :
- 300 UI/0,5 mL (22 µg de follitropine alfa/cartouche de 0,5 mL),
- 450 UI/0,75 mL (33 µg de follitropine alfa/cartouche de 0,75 mL),
- 900 UI/1,5 mL (66 µg de follitropine alfa/cartouche de 1,5 mL).
Ces cartouches doivent être utilisées avec le stylo injecteur OVALEAP PEN, réutilisable, avec lequel elles sont toutes compatibles.
Le stylo injecteur OVALEAP PEN n'est pas fourni avec les cartouches. Il doit être prescrit par le médecin lors de la première prescription d'OVALEAP. Il est délivré gratuitement au patient en pharmacie (commande auprès du grossiste).
- Conservation
Après ouverture, la cartouche dans le stylo peut être conservée pendant 28 jours au maximum.
Il est recommandé d'inscrire la date de première utilisation dans le carnet de suivi fourni avec le stylo OVALEAP PEN.
- Des schémas posologiques variables selon les indications
La première injection doit être réalisée sous surveillance médicale.
L'autoadministration peut être envisagée sous réserve de l'accord du médecin et d'une formation préalable du patient.
La posologie et la fréquence des injections sont choisies en fonction de l'indication, puis ajustée selon la réponse individuelle de la patiente :
- Chez les patientes anovulatoires, les injections sont généralement quotidiennes, à une dose standard de 75 à 150 UI de FSH :
- Le traitement débute dans les 7 premiers jours du cycle menstruel.
- Les doses sont augmentées de préférence de 37,5 ou 75 UI, en respectant un intervalle de 7 jours ou de préférence 14 jours. L'ajustement posologique vise à obtenir une réponse adéquate mais non excessive, en s'appuyant sur la taille du follicule par échographie et/ou la sécrétion estrogénique.
- La dose quotidienne maximale ne doit habituellement pas dépasser 225 UI de FSH.
- Chez les patientes traitées dans le cadre d'une AMP pour provoquer une superovulation, la dose initiale est de 150 à 225 UI de follitropine alfa par jour, en commençant le 2e ou 3e jour du cycle.
- Le traitement est poursuivi et ajusté jusqu'à l'obtention d'une croissance folliculaire adéquate, déterminée par le contrôle des taux plasmatiques d'estrogènes et/ou un examen échographique.
- La dose maximale quotidienne est de 450 UI. En général, un développement folliculaire adéquat est obtenu en moyenne vers le 10e jour de traitement (de 5 à 20 jours).
- Une fois la réponse satisfaisante obtenue, la patient reçoit 250 µg de r-hCG, ou 5 000 UI à 10 000 UI maximum d'hCG en dose unique, 24 à 48 heures après la dernière injection de follitropine alfa pour induire la maturation folliculaire finale.
- Chez les femmes présentant un déficit en LH et en FSH (hypogonadisme hypogonadotrophique), la follitropine alfa est administré en association avec la lutropine alfa dans le but de développer un seul follicule de De Graaf mature, à partir duquel l'ovule sera libéré après administration de hCG.
- La follitropine alfa doit être administrée en injections quotidiennes (75 à 150 UI de FSH), en même temps que la lutropine alfa (75 UI).
- Le traitement peut être débuté à tout moment du cycle. La dose est ajustée en fonction de la réponse de la patiente.
- Chez les hommes, la posologie recommandée est de 150 UI, 3 fois par semaine, en association avec l'hCG, pendant 4 mois minimum.
Identité administrative
- Liste I
- Prescription réservée aux spécialistes en gynécologie, en gynécologie-obstétrique, en endocrinologie et métabolisme ou en urologie
- Surveillance particulière pendant le traitement
- Remboursable à 100 %
- OVALEAP 300 UI/0,5 mL (22 µg/0,5 mL), boîte de 1 cartouche + 10 aiguilles d'injection, CIP 3400927903021, prix public TTC = 92,83 euros
- OVALEAP 450 UI/0,75 mL (33 µg/0,75 mL), boîte de 1 cartouche + 10 aiguilles d'injection, CIP 3400927903199, prix public TTC = 137,51 euros
- OVALEAP 900 UI/1,5 mL (66 µg/1,5 mL), boîte de 1 cartouche + 20 aiguilles d'injection, CIP 3400927903250, prix public TTC = 269,53 euros
- Agrément aux collectivités
- OVALEAP PEN stylo injecteur, code EAN 3700300100017
- Laboratoire Teva Santé
Pour aller plus loin
Se reporter à la monographie VIDAL d'OVALEAP
Avis de la Commission de la transparence (HAS, 25 novembre 2015)
Résumé EPAR à l'intention du public (EMA, mise à jour le 3 octobre 2014)
Sur VIDAL.fr
Médicaments biosimilaires : l'interchangeabilité désormais "envisageable" en cours de traitement (4 mai 2016)
BEMFOLA (follitropine alfa) : nouveau médicament biosimilaire dans la prise en charge de l'infertilité (28 mai 2015)
Pour aller plus loin
Consultez les monographies VIDAL
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 6 minutes
6 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.