Bien que rares en France, les tuberculoses MDR sont en nette augmentation avec 112 cas recensés en 2015 contre 40 en 2010 (illustration).
Nouveau principe actif antibiotique dans la tuberculose pulmonaire multirésistante
DELTYBA 50 mg comprimé pelliculé est un nouvel antibiotique dont le principe actif, le delamanide, est le premier représentant de la classe des nitro-dihydro-imidazooxazoles ayant une activité bactéricide contre les Mycobacterium tuberculosis.
DELTYBA est indiqué, dans le cadre d'une association appropriée avec d'autres médicaments, dans le traitement de la tuberculose pulmonaire multirésistante (TB-MDR) chez les patients adultes, lorsque l'utilisation d'un autre schéma thérapeutique efficace est impossible pour des raisons de résistance ou d'intolérance (Cf. VIDAL Reco Tuberculose pulmonaire).
Selon l'OMS (2014), la TB-MDR est une infection à mycobactéries résistantes à l'isoniazide et la rifampicine, les 2 médicaments majeurs du traitement de la tuberculose (Cf. Tableau I).
Parmi les tuberculoses MDR, on distingue :
- les tuberculoses pré ultra-résistante (pré-XDR) quand les mycobactéries sont également résistantes aux fluoroquinolones ou à un antituberculeux injectable de 2e ligne,
- les tuberculoses ultra-résistante (XDR) lorsque les mycobactéries sont également résistantes aux quatre classes thérapeutiques d'antituberculeux de 2e ligne.
Tableaux I - Les différents groupes d'antituberculeux recommandés par l'OMS
| Groupes | Substances actives | |
| Antituberculeux de 1re ligne | Groupe I | Isoniazide Ethambutol Pyrazinamide Rifampicine |
| Antituberculeux de 2e ligne | Groupe II : antituberculeux injectables | Amikacine Streptomycine Capréomycine (ATU nominative depuis 2009) Kanamycine** |
| Groupe III : fluoroquinolones | Lévofloxacine Moxifloxacine Ofloxacine Gatifloxacine** |
|
| Groupe IV : antituberculeux bactériostatiques oraux | Acide para-aminosalicylique (PAS) Ethionamide (ATU nominative) Cyclosérine (ATU nominative) Térizidone** Prothionamide** Sodium para-aminosalicylate (PAS-Na)*** |
|
| Groupe V : antituberculeux dont les données d'efficacité et/ou de tolérance à long terme dans le traitement de la TB-MR sont limitées | Amoxicilline/acide clavulanique Bédaquiline* (ATU de cohorte) Clarithromycine Clofazimine Delamanide* Imipenem/cilastatine Isoniazide à forte dose Linézolide* Méropenem Thioacétazone** |
** non commercialisé en France
*** non commercialisé en France comme antituberculeux
Des données d'efficacité à court terme basées sur une étude de phase II versus placebo
L'efficacité et la pharmacocinétique de DELTYBA repose sur une étude principale de phase II (étude 204), randomisée, en double aveugle versus placebo ayant inclus 421 patients atteints de tuberculose pulmonaire multirésistante (TB-MDR) à Mycobacterium et dont la culture des expectorations était positive.
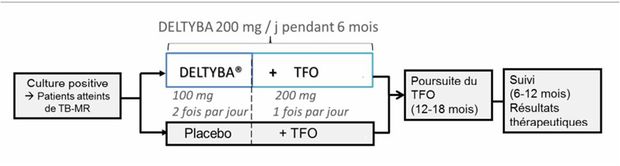
Les patients recevaient 2 schémas posologiques de delamanide (100 mg ou 200 mg) en association à un traitement de fond optimisé (TFO) pendant 2 mois (Cf. Figure 1).
Figure 1 - Schéma de l'étude 204
(d'après l'avis de la Commission de la transparence du 20 janvier 2016)
(d'après l'avis de la Commission de la transparence du 20 janvier 2016)

Le TFO associait au moins 4 médicaments sensibles selon la classification des antituberculeux recommandés par l'OMS (Cf. Tableau I ci-dessus) :
- 1 médicament du 1er groupe : éthambutol, pyrazinamide ;
- au moins 1 antituberculeux injectable, préférenciellement dans l'ordre suivant : streptomycine, amikacine (kanamycine, capréomycine, non commercialisés en France) ;
- et 1 médicament de la classe des fluoroquinolones, préférentiellement dans l'ordre suivant : lévofloxacine, ofloxacine.
Sur le critère principal de jugement, défini par la proportion de patients dont la culture des expectorations s'était négativée à 2 mois (57e jour), la supériorité de la delamanide a été démontrée versus placebo avec des taux de 45,4 % (64/141) dans le groupe DELTYBA 100 mg, 41,9 % (57/136) dans le groupe DELTYBA 200 mg et 29,6 % (37/125) dans le groupe placebo (p versus placebo < 0,05).
Considérant les sous-groupes de patients avec ou sans cavitation à l'inclusion, la négativation des cultures des expectorations au 57e jour a été plus importante avec DELTYBA par rapport au placebo en cas de cavitation présente à l'inclusion mais la différence n'a pas été statistiquement significative en l'absence de cavitation à l'inclusion.
Des données d'efficacité à 6 mois (étude 208 en ouvert) et de suivi à long terme pendant 6 mois supplémentaires (étude 116 observationnelle) des patients initialement randomisés dans l'étude de phase II (étude 204) suggèrent que la prolongation de la durée de traitement par DELTYBA jusqu'à 6 mois (durée retenue par l'AMM) en association au TFO (jusqu'à 24 mois) améliore la réponse thérapeutique (par rapport à une durée plus courte < ou = 2 mois).
Toutefois, ces données ne permettent pas de quantifier l'impact de DELTYBA sur la morbi-mortalité des patients traités, ni par rapport aux autres antituberculeux du groupe V disponibles, notamment la bédaquilline qui est actuellement disponible en ATU de cohorte.
Leur transposabilité à la pratique clinique actuelle n'est pas assurée car les traitements de fond utilisés diffèrent de ceux actuellement recommandés en France chez les patients TB-MDR.
De plus, l'impact de DELTYBA sur la qualité de vie des patients et sur l'observance thérapeutique n'est pas documenté.
Un profil de tolérance favorable dans l'ensemble, en dehors du risque d'allongement de l'intervalle QT
Les données de tolérance sur DELTYBA issues de l'étude de phase II et des données d'extension du traitement à 6 mois sont très limitées.
Il en ressort que le profil de tolérance de DELTYBA semble favorable dans l'ensemble, en dehors du risque d'allongement de l'intervalle QT, signalé selon le résumé des caractéristiques du produit (RCP) chez 9,9 % des patients recevant DELTYBA 100 mg deux fois par jour contre 3,8 % des patients traités par placebo + TFO.
Défini comme le problème de sécurité d'emploi le plus important de DELTYBA, cet allongement de l'intervalle QT peut rendre son utilisation difficile dans la pratique en particulier en cas d'association à d'autres médicaments antituberculeux allongeant le QT, comme la moxifloxacine.
Ce risque fait l'objet de contre-indication et de mises en garde dans le résumé des caractéristiques du produit (RCP) de DELTYBA.
Les principaux facteurs contribuant à l'allongement de l'intervalle QTc sont l'hypoalbuminémie, en particulier lorsqu'elle est < 2,8 g/ml, et l'hypokaliémie.
Ce médicament fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté.
Une AMM conditionnelle : des preuves supplémentaires attendues
Délivrée en 2014, l'autorisation de mise sur le marché (AMM) européenne de DELTYBA est conditionnée à la réalisation d'une étude confirmatoire de phase III dans les tuberculoses multirésistantes (étude 213).
Cette étude multicentrique (18 centres) randomisée en double aveugle versus placebo est actuellement en cours dans 7 pays. Son recrutement est terminé avec 511 patients inclus.
Son objectif est d'évaluer pendant une période de 6 mois (phase intensive du traitement de la TB-MDR) l'efficacité de DELTYBA comparativement à celle d'un placebo, tous deux en association à un traitement de fond optimisé (TFO).
Les résultats à long terme seront ensuite recueillis pendant une période de suivi de 6 à 12 mois.
Figure 1 - Schéma de l'étude 213
(d'après l'avis de la Commission de la transparence du 20 janvier 2016)
(d'après l'avis de la Commission de la transparence du 20 janvier 2016)
Les résultats de cette étude sont attendus pour le 2e trimestre de l'année 2017.
L'Agence européenne du médicament (EMA) a également demandé une étude complémentaire pour confirmer la posologie de DELTYBA.
Delamanide, une nouvelle option thérapeutique en alternative à la bédaquilline
Dans son avis du 20 janvier 2016, la Commission de la transparence considère que DELTIBA représente une nouvelle option thérapeutique, en alternative à la bédaquiline, en association avec une pluri-antibiothérapie dans :
- "les tuberculoses MDR (résistantes à l'isoniazide et à la rifampicine) lorsque le schéma thérapeutique recommandé n'est pas applicable en raison d'intolérance ou de résistances ;
- les tuberculoses pré-XDR (résistantes à l'isoniazide, à la rifampicine, aux fluoroquinolones ou à un aminoside injectable) pour maintenir un minimum de 4 médicaments efficaces ;
- les tuberculoses XDR (résistantes à l'isoniazide, à la rifampicine, aux fluoroquinolones et à un aminoside injectable) pour diminuer le recours aux médicaments du groupe V dont l'efficacité est souvent mal évaluée et la toxicité souvent importante. Dans ce cas le delamanide pourrait être utilisé avec ou à la place d'un médicament du groupe V (cf. tableau 1)."
Lorsque le delamanide est utilisé avec une fluoroquinolone ou un médicament du groupe V, des précautions particulières sont nécessaires, comme avec la bédaquiline, en raison du risque potentiel d'interactions médicamenteuses synergiques, en particulier l'allongement du QT.
Compte tenu des données préliminaires pour l'instant rassurantes et du peu d'alternatives disponibles en traitement de dernière ligne de la tuberculose mulirésistante, la Commission considère que DELTYBA apporte un service médical rendu (SMR) important chez les patients atteints d'une tuberculose XDR, pré-XDR ou MDR, lorsque le schéma thérapeutique recommandé n'est pas applicable en raison d'intolérance ou de résistances.
Dans cette indication, l'amélioration du SMR apporté par DELTYBA est modéré (ASMR III) au même titre que SIRTURO (bédaquiline).
DELTYBA en pratique
DELTYBA est un médicament orphelin uniquement disponible à l'hôpital.
Le traitement par delamanide doit être :
- instauré et surveillé par un médecin expérimenté dans la prise en charge des infections à Mycobacterium tuberculosis multirésistant et après avis auprès d'un groupe d'experts pour le choix du schéma thérapeutique (ex. : Centre National de Référence des Mycobactéries et de la Résistance des Mycobactéries aux Antituberculeux [CNR-MyRMA ]) ;
- administré par thérapie sous observation directe (TOD) : le patient prend ses antituberculeux sous les yeux d'une personne désignée.
La posologie est de 100 mg de delamanide 2 fois par jour, soit 2 comprimés de DELTYBA 2 fois par jour, pendant 24 semaines (6 mois). Les comprimés doivent être pris au cours des repas.
Au-delà des 24 semaines de traitement par DELTYBA, le traitement par médicaments standards doit être poursuivi conformément aux recommandations officielles.
Surveiller l'ECG, l'albuminémie et la kaliémie
L'allongement de l'intervalle QTc à l'électrocardiogramme (ECG) nécessite une surveillance cardiaque (ECG) renforcée :
- avant l'instauration du traitement,
- tous les mois pendant la cure.
Le traitement par delamanide ne doit pas être débuté ou doit être interrompu si l'intervalle QTcF est supérieur à 500 ms.
En outre, la surveillance doit porter sur :
- les électrolytes sériques (potassium) en début de traitement. En cas d'anomalie, celle-ci doit être corrigée ;
- l'albuminémie : le traitement par delamanide est contre-indiqué en cas d'hypoalbuminémie (albumine sérique < 2,8 g/dL), en raison d'un risque accru d'allongement de l'intervalle QTc.
L'administration concomitante de DELTYBA et des inhibiteurs puissants du CYP3A4 entraîne une exposition accrue de 30 % au principal métabolite du delamanide, le DM-6705, et augmente le risque cardiaque.
En cas d'administration concomitante avec des fluoroquinolones, la surveillance par ECG doit être renforcée et réalisée plus fréquemment.
L'utilisation de moxifloxacine est déconseillée en association avec le delamanide.
Identité administrative
- Liste I
- Prescription hospitalière
- Boîte de 48, CIP 3400930010570
- Agrément aux collectivités (Journal officiel du 27 avril 2016, texte 25) assorti de la condition suivante : prescription restreinte aux médecins expérimentés dans la prise en charge des tuberculoses multirésistantes et après avis auprès d'un groupe d'experts pour le choix du schéma thérapeutique (ex. : CNR-MyRMA)
- Laboratoire Otsuka Pharmaceutical France
Pour aller plus loin
Avis de la Commission de la Transparence (HAS, 20 janvier 2016)
Résumé EPAR à l'intention du public (EMA, mise à jour du 18 avril 2016)
The use of delamanid in the treatment of multi-drug resistant tuberculosis: interim policy guidance (OMS, 2014)
Avis relatif aux lignes directrices de la prise en charge de la tuberculose à bacilles résistants (HCSP, 16 et 18 décembre 2014)
Sur VIDAL.fr
Nouvelle stratégie thérapeutique dans la tuberculose pulmonaire : décryptage du Dr Trémolières (12 novembre 2015)
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 9 minutes
9 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.