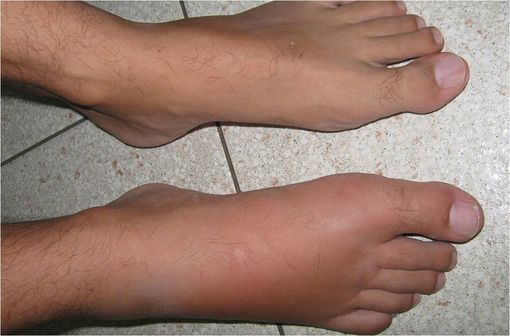
Érysipèle du pied droit (illustration @Grook Da Oger, sur Wikimedia).
SIVEXTRO, un nouvel antibiotique hospitalier
SIVEXTRO (tédizolide) est un nouvel antibiotique de la classe des oxazolidones, indiqué dans le traitement des infections bactériennes aiguës de la peau et des tissus mous (IBAPTM) chez les adultes.
Deux formes pharmaceutiques sont proposées, en comprimé pelliculé et en poudre pour solution à diluer pour perfusion intra-veineuse (IV), toutes deux dosées à 200 mg de tédizolide.
Commercialisé à l'hôpital uniquement, SIVEXTRO fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
Le tédizolide, principalement actif sur contre les bactéries à Gram positif
Le principe actif de SIVEXTRO est le phosphate de tédizolide, une prodrogue du tédizolide, de la classe des oxazolidinones.
Le tédizolide agit en inhibant la synthèse protéique des bactéries, par liaison à la sous-unité 50S du ribosome bactérien.
Principalement actif contre les bactéries à Gram positif, le tédizolide présente une action bactériostatique in vitro contre les entérocoques (E. faecalis), les streptocoques (S. pyogènes, S. agalactiae, S. anginosus, S. intermédius et S. constellatus) et les staphylocoques dont le Staphylococcus aureus résistant à la méticilline (SARM).
Comme pour le linézolide (ZYVOXID), premier représentant de la classe des oxazolidinones, l'intérêt clinique potentiel du tédizolide rédide dans son activité in vitro sur les SARM, les Staphylococcus aureus de sensibilité intermédiaire/hétérogène aux glycoprotéines (GISA/hGISA) ainsi que sur les entérocoques résistants à la vancomycine (VRE).
ESTABLISH-1 et 2 : 2 études de non-infériorité versus linézolide
L'efficacité et la tolérance du phosphate de tédizolide ont principalement été évaluées au cours de 2 études contrôlées de phase III, ESTABLISH-1 et ESTABLISH-2, versus linézolide.
L'objectif principal était de démontrer la non-infériorité du phosphate de tédizolide 200 mg x 1/jour pendant 6 jours par rapport au linézolide 600 mg x 2/jour pendant 10 jours chez des patients atteints d'IBAPTM.
Dans l'étude ESTABLISH-1, les patients étaient uniquement traités par voie orale et dans l'étude ESTABLISH-2, le traitement était administré par voie IV puis per os (PO).
En l'absence de critères de gravité spécifique nécessitant une antibiothérapie IV, la majorité des patients de l'étude ESTABLISH-2 n'a reçu qu'une dose IV de tédizolide et 2 doses IV de linézolide : les données reposent donc en grande majorité sur l'administration PO.
Le critère de jugement principal était le succès clinique évalué par l'investigateur à la visite post-traitement (7 à 14 jours après la fin du traitement), défini par :
- la disparition ou la quasi-disparition de la plupart des signes spécifiques de la maladie, des symptômes et, s'ils étaient présents à l'inclusion, des signes d'infection systémique (lymphadénopathie, fièvre, neutrophiles immatures > 10 %, numération anormale des globules blancs)
- et l'absence de nouveaux signes, symptômes ou complications attribuables à l'IBAPTM, impliquant l'arrêt du traitement antibiotique pour le traitement de la lésion primaire.
La non-infériorité du tédizolide vis-à-vis du linézolide a été démontrée dans les deux études, avec un profil de tolérance comparable entre les deux traitements.
Les effets indésirables le plus fréquemment observés dans les groupes tédizolide et linézolide ont été des nausées, céphalées, diarrhées, vomissements, vertiges, abcès et cellulites
Des données insuffisantes dans les IBAPTM sévères et/ou dues à des bactéries multirésistantes
Les types d'infections traitées dans ces études ont principalement été des IBAPTM de type cellulites non nécrosantes ou érysipèles (environ 46 %), des plaies infectées (29 %) et des abcès cutanés majeurs (25 %). Les autres types d'infections cutanées n'ont pas été étudiés.
Le staphylocoque doré a été le germe le plus fréquemment isolé et la majorité des infections a été monomicrobienne.
Dans son avis du 21 octobre 2015, la Commission de la transparence a jugé que ces données étaient "actuellement insuffisantes pour évaluer son apport thérapeutique dans la prise en charge des infections cutanées et des tissus mous sévères et/ou dues à des bactéries à Gram positif multirésistantes relevant d'une antibiothérapie par le linézolide, en particulier dans les situations où l'usage de la vancomycine (actuel traitement de référence des infections graves à SARM) est souvent inadaptée, telles que :
- les infections à SARM avec CMI à la vancomycine > 2 µg/mL (facteur prédictif d'échec à la vancomycine),
- ou dues à des souches de Staphylococcus aureus de sensibilité intermédiaire/hétérogène aux glycopeptides (GISA/hGISA),
- ainsi que les infections à entérocoques résistants à la vancomycine (VRE),
- malgré une sensibilité de ces souches au tédizolide in vitro."
Stratégie thérapeutique : une place plus restreinte que l'indication d'AMM
Dans son avis du 21 octobre 2015, la Commission de la transparence considère que SIVEXTRO "peut être proposé dans les infections sans notion de gravité, pour lesquelles une étiologie staphylococcique est prouvée ou suspectée (infections suppuratives) et que la résistance à la méticilline est prouvée ou fortement suspectée".
Le service médical rendu (SMR) de SIVEXTRO a été jugé important dans ces seules situations.
Le tédizolide a l'avantage d'être aussi efficace en dose unique journalière pendant 6 jours qu'un traitement par le linézolide en 2 prises journalières pendant 10 jours mais, en cas d'IBAPTM graves et/ou dues à des bactéries multirésistantes, l'efficacité du tédizolide sera potentiellement moins bonne que celle du linézolide en raison de sa moindre efficacité dans les essais cliniques chez ces patients.
Par ailleurs, SIVEXTRO ne nécessite pas de surveillance des concentrations plasmatiques en tédizolide, ni de la fonction rénale.
SIVEXTRO en pratique
- Voie orale ou injectable
Cependant, si un effet antibiotique rapide est nécessaire, l'administration par voie intraveineuse doit être envisagée.
En cas d'initiation par perfusion, une poursuite du traitement par voie orale peut être envisagée selon le contexte clinique.
- Prise unique de 200 mg par jour
Il n'y a pas de données disponibles de sécurité et d'efficacité pour des traitements de durée supérieure à 6 jours.
Les comprimés pelliculés peuvent être pris au cours ou en dehors des repas.
Après administration orale à jeun, le temps jusqu'à la concentration maximale de tédizolide est diminué de 6 heures par rapport à l'administration avec un repas hyperlipidique et hypercalorique.
SIVEXTRO poudre pour solution à diluer pour perfusion doit être administré en perfusion intraveineuse de 60 minutes.
La reconstitution est réalisée avec de l'eau pour préparations injectables.
La solution reconstituée est ensuite diluée dans 250 ml de solution injectable de chlorure de sodium à 0,9 %.
Identité administrative
- Liste I
- Prescription hospitalière
- Forme orale : boîte de 6 comprimés pelliculés, CIP 3400930011140
- Forme injectable : boîte de 6 flacon-tubes de 10 ml, CIP 3400930011164
- Agrément aux collectivités uniquement chez les patients adultes ayant des infections sans notion de gravité, pour lesquelles une étiologie staphylococcique est prouvée ou suspectée (infections suppuratives) et que la résistance à la méticilline est prouvée ou fortement suspectée (Journal officiel du 29 décembre 2016 - texte 45)
- Laboratoire MSD France
Pour aller plus loin
Avis de la Commission de la Transparence (HAS, 21 octobre 2015)
Plan européen de gestion des risques en anglais (EMA, mise à jour du 12 novembre 2015)
Résumé EPAR à l'intention du public (EMA, mise à jour du 12 novembre 2015)
Sur Vidal.fr
Consommation d'antibiotiques : la France toujours dans le peloton de tête européen (19 novembre 2015)
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Pour recevoir gratuitement toute lãactualitûˋ par mail Je m'abonne !

 6 minutes
6 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.