La fibrose pulmonaire idiopathique est caractérisée par la formation de tissu cicatriciel dans les poumons en l'absence de toute cause connue (illustration @IPFeditor sur Wikimedia).
ESBRIET 267 mg gélule est désormais remboursable à 30 % au lieu de 15 %. Ce nouveau taux de remboursement est entré en application le 1er janvier 2016.
Le périmètre de l'indication remboursable d'ESBRIET correspond à celui de l'arrêté du 9 octobre 2015 (Fiche d'information thérapeutique) et s'appuie sur les conclusions de la Commission de la transparence publiées en février 2015 :
"ESBIET est remboursable dans la fibrose pulmonaire idiopathique (FPI) légère à modérée, uniquement pour les patients avec un diagnostic clinique, radiologique et/ou histologique confirmé de FPI, qui ne consomment pas de tabac et avec les critères fonctionnels respiratoires suivants :
Le service médical rendu d'ESBRIET passe de "faible" à "modéré"
La révision du taux de remboursement d'ESBRIET par l'Uncam est consécutive à la réévaluation de l'inscription au remboursement d'ESBRIET par la Commission de la Transparence (février 2015).
La première évaluation datait de 2012 et avait conclu à un service médical rendu (SMR) faible et à une amélioration du service médical rendu (ASMR) mineure.
Dans cette évaluation initiale, la Commission de la transparence avait limité le remboursement aux seuls patients atteints de fibrose pulmonaire idiopathique avec un diagnostic clinique et radiologique confirmé de FPI et avec les critères diagnostiques fonctionnels respiratoires suivants : CVF >= 50 % (capacité vitale forcée) et DLCo >= 35 % (capacité de diffusion du monoxyde de carbone).
En 2012, la Commission de la transparence avait rendu son avis sur la base de 2 études évaluant l'efficacité d'ESBRIET versus placebo à la 72e semaine (779 patients).
Le critère de jugement principal était la capacité vitale forcée. Sur ce critère, la différence absolue entre le groupe ESBRIET et le groupe placebo était de 4,4 % dans une des deux études. Aucune différence entre les groupes n'était démontrée dans l'autre étude.
Les critères secondaires de morbi-mortalité étaient le délai d'aggravation de la FPI, la survie sans progression et le risque de progression ou de survenue de décès.
Un critère intermédiaire d'efficacité (évaluation de la fonction pulmonaire marqueur de la progression de la maladie) était pris en compte.
Les résultats étaient en faveur de la pirfénidone, mais la différence était jugée faible et peu significative.
Etude ASCEND : nouvelles données d'efficacité d'ESBRIET par rapport au placebo
En février 2015, le laboratoire Roche a demandé une nouvelle évaluation d'ESBRIET afin de prendre en compte les nouvelles données d'efficacité issues de l'étude ASCEND (PIPF-016).
L'étude ASCEND a été réalisée à la demande de la FDA (Food and Drug Administration), qui a approuvé ESBRIET en 2014.
Il s'agit d'une étude de phase III, randomisée en double aveugle contre placebo et multicentrique (9 pays participants), regroupant 555 patients atteints de fibrose pulmonaire idiopathique.
L'objectif de cette étude était d'évaluer l'efficacité et la tolérance de la pirfénidone versus placebo, sur les critères suivants :
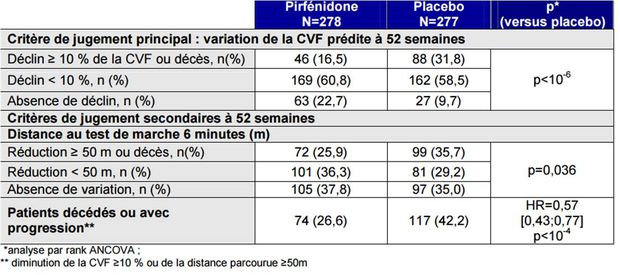
L'analyse des résultats (voir Tableau I) a démontré la supériorité de la pirfénidone versus placebo sur le critère de jugement principal, se traduisant notamment par une absence de diminution de la CVF prédite pour 22,7 % des patients du groupe pirfénidone contre 9,7 % du groupe placebo. La diminution absolue de CVF prédite a été de - 6,2 dans le groupe pirfédinone.
En terme de survie sans progression et de distance au test de marche, les résultats étaient en faveur de la pirfénidone.
Profil de tolérance : pas de changement
La Commission de la transparence a également réévalué les données de tolérance, actualisées à partir de l'étude ASCEND, de l'étude RECAP et des données intermédiaires de l'étude PASSPORT (voir l'avis de la Commission de la transparence de février 2015).
Le profil de tolérance connu n'est pas modifié par les nouvelles données fournies.
Les événements indésirables les plus fréquemment rapportés sont des troubles gastrointestinaux (nausées, dyspepsie, diarrhée), rash cutané et photosensibilité, ainsi qu'une fatigue. Le taux des enzymes hépatiques est à surveiller en cours de traitement.
A meilleur SMR, meilleur taux de remboursement
En l'absence, à ce jour, de traitement curatif de la fibrose pulmonaire idiopathique et de consensus sur la définition des stades d'évolution de cette maladie, la Commission de la transparence s'est prononcée en faveur du maintien du remboursement d'ESBRIET avec un taux de 30 % dans l'indication définie par l'arrêté du 9 octobre 2015 (voir en début d'article).
Pour mémoire
ESBRIET est indiqué chez l'adulte pour le traitement de la fibrose pulmonaire idiopathique légère à modérée.
ESBRIET est un médicament orphelin et d'exception. Sa prescription doit être en conformité avec la fiche d'information thérapeutique en vigueur.
ESBRIET est soumis à prescription hospitalière réservée aux spécialistes en pneumologie. Une surveillance particulière pendant le traitement est nécessaire pendant le traitement.
Le schéma posologique d'ESBRIET comporte :
Pour aller plus loin
Avis relatif aux décisions de l'Union nationale des caisses d'assurance maladie portant fixation des taux de participation de l'assuré applicables à des spécialités pharmaceutiques (Journal officiel du 5 janvier 2016 - texte 103)
Avis de la Commission de la Transparence (HAS, 14 mars 2012)
Avis de la Commission de la Transparence (HAS, 18 février 2015)
Etude ASCEND
King TE Jr, Bradford WZ, Castro-Bernardini S et al. The ASCEND study group. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med 2014 (Résumé en anglais)
Résultats de l'essai de phase III ASCEND sur la pirfénidone dans la fibrose pulmonaire idiopathique présentés au congrès de l'American Thoracic Society et publiés dans le New England Journal of Medicine (Communiqué du laboratoire Intermune, 2014)
Le périmètre de l'indication remboursable d'ESBRIET correspond à celui de l'arrêté du 9 octobre 2015 (Fiche d'information thérapeutique) et s'appuie sur les conclusions de la Commission de la transparence publiées en février 2015 :
"ESBIET est remboursable dans la fibrose pulmonaire idiopathique (FPI) légère à modérée, uniquement pour les patients avec un diagnostic clinique, radiologique et/ou histologique confirmé de FPI, qui ne consomment pas de tabac et avec les critères fonctionnels respiratoires suivants :
- capacité vitale forcée (CVF) supérieure ou égale à 50 %,
- et capacité de diffusion du monoxyde de carbone (DLco) supérieure ou égale à 30 %."
Le service médical rendu d'ESBRIET passe de "faible" à "modéré"
La révision du taux de remboursement d'ESBRIET par l'Uncam est consécutive à la réévaluation de l'inscription au remboursement d'ESBRIET par la Commission de la Transparence (février 2015).
La première évaluation datait de 2012 et avait conclu à un service médical rendu (SMR) faible et à une amélioration du service médical rendu (ASMR) mineure.
Dans cette évaluation initiale, la Commission de la transparence avait limité le remboursement aux seuls patients atteints de fibrose pulmonaire idiopathique avec un diagnostic clinique et radiologique confirmé de FPI et avec les critères diagnostiques fonctionnels respiratoires suivants : CVF >= 50 % (capacité vitale forcée) et DLCo >= 35 % (capacité de diffusion du monoxyde de carbone).
En 2012, la Commission de la transparence avait rendu son avis sur la base de 2 études évaluant l'efficacité d'ESBRIET versus placebo à la 72e semaine (779 patients).
Le critère de jugement principal était la capacité vitale forcée. Sur ce critère, la différence absolue entre le groupe ESBRIET et le groupe placebo était de 4,4 % dans une des deux études. Aucune différence entre les groupes n'était démontrée dans l'autre étude.
Les critères secondaires de morbi-mortalité étaient le délai d'aggravation de la FPI, la survie sans progression et le risque de progression ou de survenue de décès.
Un critère intermédiaire d'efficacité (évaluation de la fonction pulmonaire marqueur de la progression de la maladie) était pris en compte.
Les résultats étaient en faveur de la pirfénidone, mais la différence était jugée faible et peu significative.
Etude ASCEND : nouvelles données d'efficacité d'ESBRIET par rapport au placebo
En février 2015, le laboratoire Roche a demandé une nouvelle évaluation d'ESBRIET afin de prendre en compte les nouvelles données d'efficacité issues de l'étude ASCEND (PIPF-016).
L'étude ASCEND a été réalisée à la demande de la FDA (Food and Drug Administration), qui a approuvé ESBRIET en 2014.
Il s'agit d'une étude de phase III, randomisée en double aveugle contre placebo et multicentrique (9 pays participants), regroupant 555 patients atteints de fibrose pulmonaire idiopathique.
L'objectif de cette étude était d'évaluer l'efficacité et la tolérance de la pirfénidone versus placebo, sur les critères suivants :
- critère de jugement principal : variation du pourcentage de CVFp (capacité vitale forcée prédite) entre l'inclusion et la 52ème semaine (la CVF correspond au volume d'air expulsé avec force jusqu'au volume résiduel [VR] à partir de la capacité pulmonaire totale [CPT]) ;
- critères de jugement secondaire :
- variation de la distance parcourue au test de marche de 6 minutes ;
- survie sans progression ;
- mortalité toutes causes et en lien avec la fibrose pulmonaire idiopathique.
L'analyse des résultats (voir Tableau I) a démontré la supériorité de la pirfénidone versus placebo sur le critère de jugement principal, se traduisant notamment par une absence de diminution de la CVF prédite pour 22,7 % des patients du groupe pirfénidone contre 9,7 % du groupe placebo. La diminution absolue de CVF prédite a été de - 6,2 dans le groupe pirfédinone.
En terme de survie sans progression et de distance au test de marche, les résultats étaient en faveur de la pirfénidone.
Tableau I - Résultats de l'étude ASCEND sur les critères de jugement (population ITT) - Extrait de l'avis de la Commission de la transparence du 18 février 2015)

Profil de tolérance : pas de changement
La Commission de la transparence a également réévalué les données de tolérance, actualisées à partir de l'étude ASCEND, de l'étude RECAP et des données intermédiaires de l'étude PASSPORT (voir l'avis de la Commission de la transparence de février 2015).
Le profil de tolérance connu n'est pas modifié par les nouvelles données fournies.
Les événements indésirables les plus fréquemment rapportés sont des troubles gastrointestinaux (nausées, dyspepsie, diarrhée), rash cutané et photosensibilité, ainsi qu'une fatigue. Le taux des enzymes hépatiques est à surveiller en cours de traitement.
A meilleur SMR, meilleur taux de remboursement
En l'absence, à ce jour, de traitement curatif de la fibrose pulmonaire idiopathique et de consensus sur la définition des stades d'évolution de cette maladie, la Commission de la transparence s'est prononcée en faveur du maintien du remboursement d'ESBRIET avec un taux de 30 % dans l'indication définie par l'arrêté du 9 octobre 2015 (voir en début d'article).
Pour mémoire
ESBRIET est indiqué chez l'adulte pour le traitement de la fibrose pulmonaire idiopathique légère à modérée.
ESBRIET est un médicament orphelin et d'exception. Sa prescription doit être en conformité avec la fiche d'information thérapeutique en vigueur.
ESBRIET est soumis à prescription hospitalière réservée aux spécialistes en pneumologie. Une surveillance particulière pendant le traitement est nécessaire pendant le traitement.
Le schéma posologique d'ESBRIET comporte :
- 1 phase d'initiation de 14 jours correspondant à une augmentation progressive de la dose d'ESBRIET pour atteindre la dose d'entretien quotidienne :
- jours 1 à 7 : 1 gélule de 267 mg, trois fois par jour (soit 801 mg/jour)
- jours 8 à 14 : 2 gélules, trois fois par jour (soit 1602 mg/jour)
- jour 15 et au-delà : 3 gélules, trois fois par jour (soit 2403 mg/jour)
- 1 phase d'entretien : 3 gélules de 367 mg 3 fois par jour (2 403 mg/jour), administrées avec un aliment.
Pour aller plus loin
Avis relatif aux décisions de l'Union nationale des caisses d'assurance maladie portant fixation des taux de participation de l'assuré applicables à des spécialités pharmaceutiques (Journal officiel du 5 janvier 2016 - texte 103)
Avis de la Commission de la Transparence (HAS, 14 mars 2012)
Avis de la Commission de la Transparence (HAS, 18 février 2015)
Etude ASCEND
King TE Jr, Bradford WZ, Castro-Bernardini S et al. The ASCEND study group. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med 2014 (Résumé en anglais)
Résultats de l'essai de phase III ASCEND sur la pirfénidone dans la fibrose pulmonaire idiopathique présentés au congrès de l'American Thoracic Society et publiés dans le New England Journal of Medicine (Communiqué du laboratoire Intermune, 2014)
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 5 minutes
5 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.