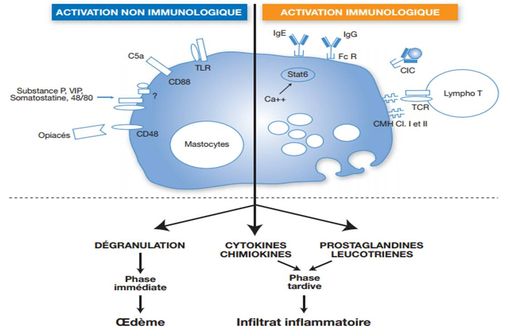
Physiopathologie de l'urticaire chronique (source : N. Gunera-Saad et coll., Décision thérapeutique en médecine générale, 2006).
Le remboursement de l'anticorps monoclonal anti-IgE, XOLAIR 150 mg solution injectable en seringue préremplie (omalizumab), est étendu à son utilisation, en seconde intention, dans le traitement de l'urticaire chronique spontanée (UCS) (Cf. Reco VIDAL Urticaire chronique).
Dans cette indication, XOLAIR 150 mg doit être utilisé en traitement additionnel aux antihistaminiques anti-H1, chez les adultes et adolescents (à partir de 12 ans) présentant une réponse insuffisante aux traitements anti-H1.
L'omalizumab, seul traitement de seconde intention dans l'UCS
XOLAIR 150 mg est le seul dosage à disposer de cette indication en dermatologie, obtenue en février 2014 (notre article du 24 avril 2014).
XOLAIR est également disponible au dosage de 75 mg, indiqué dans la prise en charge de l'asthme allergique, mais pas dans l'urticaire chronique spontanée.
Les anti-histaminiques anti-H1 constituent le traitement de première intention de l'UCS, où ils sont souvent utilisés à des doses au-delà de celles recommandées par l'autorisation de mise sur le marché (AMM).
L'omalizumab, premier médicament ayant une AMM dans le traitement de l'UCS en échec aux anti-histaminiques anti-H1, constitue la seule option thérapeutique de seconde intention.
Evaluation de la Haute Autorité de santé : un service médical rendu modéré
XOLAIR n'a pas de comparateur cliniquement pertinent.
L'évaluation de XOLAIR à la posologie de 300 mg toutes les 4 semaines dans le traitement de seconde intention de l'UCS repose sur :
- 2 études d'efficacité, ASTERIA I (Journal of Investigative Dermatology 2015) et ASTERIA II (N Engl J Med 2013) de 24 semaines et 12 semaines respectivement, comparant l'omalizumab au placebo, en addition au traitement anti-H1 aux doses de l'AMM. Le critère de jugement principal était la variation du score de sévérité du prurit (score ISS, Itchy Severity Score : voir Encadré 1) ;
- 1 étude de tolérance de 24 semaines, GLACIAL (J Allergy Clin Immunol 2013) où les patients était exposés à une dose d'anti-histaminique H1 allant jusqu'à 4 fois la dose de l'AMM ; l'efficacité (dont la variation du score ISS hebdomadaire) était un critère de jugement secondaire.
Encadré 1- Score ISS hebdomadaire (Weekly Itchy Severity Score)
| La sévérité du prurit est évaluée par le patient sur une échelle de 0 (aucun) à 3 (sévère) matin et soir. Le score quotidien correspond à la moyenne des scores du matin et du soir (soit un score de 0 à 3). Le score hebdomadaire est la somme des scores quotidiens évalués pendant 7 jours (soit un score de 0 à 21). Une variation du score >= 5 est considérée cliniquement pertinente. |
Les résultats de ces études, évalués à 12 semaines, sont homogènes et montrent la supériorité de l'omalizumab par rapport au placebo sur l'ensemble des critères étudiés, notamment sur la variation du score de prurit ISS hebdomadaire à la 12e semaine par rapport à l'inclusion.
En effet, les diminutions des scores ISS hebdomadaires ont été avec l'omalizumab de -9,4, -9,7 et -8,55 et avec le placebo de -3,63, -5,14 et -4,01 respectivement dans les études ASTERIA I, ASTERIA II et GALCIAL ; ces différences, statistiquement significatives (p < 0,0001), n'ont toutefois atteint le seuil de pertinence clinique (>= 5) que dans l'étude ASTERIA I.
Selon les résultats obtenus au score UAS7 (voir Encadré 2), il a été observé :
- un bon contrôle de la maladie (UAS<=6) chez 52 à 66 % des patients traités par omlizumab 300 mg versus 11 à 19 % dans les groupes placebo ;
- une rémission complète (UAS7 = 0) chez 34 à 44 % des patients traités par omalizumab, versus 5 à 9 % dans les groupes placebo.
Encadré 2 - Score UAS7 (Weekly Urticaria Activity Score)
| L'UAS est un score composite basé sur l'auto-évaluation par le patient, de l'intensité du prurit et du nombre de papules. L'intensité des symptômes est mesurée sur une échelle de 0 (aucun) à 3 (sévère). L'UAS quotidien est alors la moyenne des scores du matin et du soir (soit un score de 0 à 6). L'UAS7 est la somme des UAS quotidiens sur 7 jours (soit un score de 0 à 42). Une variation >= 10 points correspond à une variation cliniquement pertinente. La réponse au traitement est considérée comme bonne et la pathologie est bien contrôlée avec un score UAS7 <= 6. La sévérité de la pathologie de l'UCS peut être évaluée en fonction du score UAS7 selon les seuils suivants :
|
En termes de tolérance, des réactions au site d'injection, de l'urticaire et des infections ont été fréquemment rapportés et, dans de rares cas, des réactions d'hypersensibilité.
Bien que statistiquement significatifs et importants en termes de bon contrôle de la maladie, les effets bénéfiques de l'omalizumab sont purement suspensifs, les scores ISS et UAS7 rejoignant progressivement les valeurs observées avec le placebo après l'arrêt du traitement à S40.
De plus, ces données d'efficacité et de tolérance sont limitées dans le temps et ne permettent pas d'évaluer les bénéfices de XOLAIR sur l'UCS à long terme (plus de 6 mois).
Dans son avis du 15 avril 2015, la Commission de la transparence indique que "par conséquent, des données complémentaires sont nécessaires afin de mieux caractériser l'évolution à long terme de l'efficacité et la tolérance de l'omalizumab du fait du caractère chronique de la maladie et des incertitudes quant aux risques cardiovasculaires et aux risques liés à un traitement immunosuppresseur à long terme, notamment de cancer".
La Commission de la transparence a conclu à service médical rendu (SMR) modéré.
XOLAIR en pratique
- Posologie : 300 mg toutes les 4 semaines en injection SC
La dose recommandée est de 300 mg en injection sous-cutanée (SC) toutes les 4 semaines.
Les injections SC seront faites dans la région deltoïde du bras ou, en cas d'impossibilité, dans la cuisse. L'administration doit être réalisée par un professionnel de santé uniquement.
Les prescripteurs doivent réévaluer régulièrement la nécessité de poursuivre le traitement.
L'expérience clinique dans le traitement à long terme au-delà de 6 mois dans cette indication est limitée.
- Réduction des IgE libres pendant plusieurs semaines
Après des doses répétées 1 fois toutes les 4 semaines, les taux d'IgE libres sériques mesurés avant l'administration de la dose sont restés stables entre la 12e et la 24e semaine de traitement.
Après l'arrêt de XOLAIR, les taux d'IgE libres ont augmenté jusqu'aux taux de pré-traitement sur la période de suivi de 16 semaines sans traitement.
- Un remboursement conditionné par la conformité de la prescription à la FIT
La prescription initiale de XOLAIR 150 mg est hospitalière et annuelle.
La prescription initiale et son renouvellement sont réservés aux spécialistes en pneumologie, en pédiatrie, en dermatologie ou en médecine interne.
Le taux de remboursement de XOLAIR est fixé à 65 %. Son prix de vente au public s'élève à 408,81 € TTC (1 seringue de 1 ml).
- Pour mémoire : l'autre indication de XOLAIR
- Adulte et adolescent (à partir de 12 ans) : XOLAIR est indiqué, en traitement additionnel, pour améliorer le contrôle de l'asthme chez les patients atteints d'asthme allergique persistant sévère, ayant un test cutané positif ou une réactivité in vitro à un pneumallergène perannuel et qui, malgré un traitement quotidien par un corticoïde inhalé à forte dose et un bêta-2-agoniste inhalé à longue durée d'action, présentent une réduction de la fonction pulmonaire (VEMS < 80 % de la valeur théorique), des symptômes diurnes ou des réveils nocturnes fréquents, et des exacerbations sévères, multiples et documentées de l'asthme.
- Enfant (de 6 ans à moins de 12 ans) : XOLAIR est indiqué, en traitement additionnel, pour améliorer le contrôle de l'asthme chez les patients atteints d'asthme allergique persistant sévère, ayant un test cutané positif ou une réactivité in vitro à un pneumallergène perannuel et qui, malgré un traitement quotidien par un corticoïde inhalé à forte dose et un bêta-2-agoniste inhalé à longue durée d'action, présentent des symptômes diurnes ou des réveils nocturnes fréquents, et des exacerbations sévères, multiples et documentées de l'asthme.
Pour aller plus loin
Avis de la Commission de la Transparence (HAS, 15 avril 2015)
Arrêté du 30 octobre 2015 modifiant la liste des spécialités pharmaceutiques remboursables aux assurés sociaux - Fiche d'information thérapeutique (Journal officiel du 3 novembre 2015 - texte 19)
Arrêté du 30 octobre 2015 modifiant la liste des spécialités pharmaceutiques agréées à l'usage des collectivités (Journal officiel du 3 novembre 2015 - texte 20)
Panorama des urticaires, N. Gunera-Saad et coll., Décision thérapeutique en médecine générale, 2006 (publication d'où provient le schéma de la physiopathologie de l'urticaire).
Sarbjit S. Saini and al. Efficacy and Safety of Omalizumab in Patients with Chronic Idiopathic/Spontaneous Urticaria Who Remain Symptomatic on H1 Antihistamines: A Randomized, Placebo-Controlled Study. Journal of Investigative Dermatology 2015 ; 135 : 67–75.
Marcus Maurer and al. Omalizumab for the Treatment of Chronic Idiopathic or Spontaneous Urticaria. N Engl J Med 2013 ; 368 : 924-35.
Kaplan A. and al. Omalizumab in patients with symptomatic chronic idiopathic/spontaneous urticaria despite standard combination therapy. J Allergy Clin Immunol 2013 ; 132 (1) : 102-9.
Sur Vidal.fr
XOLAIR 150 mg solution injectable SC (omalizumab) : nouvelle indication dans l'urticaire chronique spontanée (24 avril 2014)
L'urticaire chronique spontanée, une maladie imprévisible (1er octobre 2014)
Pour aller plus loin
Consultez les monographies VIDAL
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 7 minutes
7 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.