Image endoscopique du colon d'un patient atteint de la maladie de Crohn (illustration @Samir - The Scope sur Wikimedia).
REVESTIVE 5 mg poudre et solvant pour solution injectable sous-cutanée (téduglutide) est indiqué dans le traitement du syndrome de l'intestin court chez l'adulte. Les patients doivent être en état stable après la période d'adaptation intestinale ayant suivi l'intervention chirurgicale.
Le syndrome de l'intestin court étant une maladie rare (incidence d'environ 1/1 000 000 d'habitants), REVESTIVE a été désigné comme médicament orphelin.
Commercialisé à l'hôpital uniquement, REVESTIVE fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté.
A propos du syndrome de l'intestin court
Le syndrome de l'intestin court est un trouble caractérisé par l'incapacité de l'intestin à assurer l'équilibre énergétique, protéique, hydroélectrolytique et en micro-nutriments.
Il survient à la suite d'une résection intestinale laissant en place moins de 150 à 200 cm d'intestin grêle post-duodénal (maladie de Crohn, maladie vasculaire, volvulus, etc.).
En France, la cause la plus fréquente de résection intestinale est l'infarctus mésentérique.
A la suite d'une phase aiguë de 6 semaines après la résection du grêle, se produit une phase dite d'adaptation intestinale de 6 à 12 mois caractérisée par une hyperplasie de la muqueuse colique, une hyperphagie sous le contrôle des hormones gastro-intestinales dont le GPL-2, et la mise en place précoce d'une nutrition parentérale.
C'est au cours de cette phase que le syndrome de l'intestin court peut être identifié.
Transitoire dans la moité des cas, l'insuffisance intestinale est définitive dans les cas restants, les facteurs prédictifs de survenue étant :
- la longueur du grêle restant (1 m pour l'entérostomie terminale, 60 cm pour l'anastomose jéjuno-colique, 30 cm pour l'anastomose jéjuno-iléo-colique),
- la durée > 2 ans de la dépendance à la nutrition prentérale (survie estimée à 1 an : 94 % et à 3 ans : 73 %)
- et un taux de citrulline < 20 µmol/L.
Le téduglutide, nouveau principe actif analogue du GLP-2
Le principe actif de REVESTIVE est le téduglutide.
Obtenu par la technique de l'ADN recombinant, le téduglutide est un analogue du glucagon-like peptide-2 (GLP-2), un peptide normalement sécrété par les cellules L de l'intestin, qui augmente l'absorption intestinale.
Le téduglutide se compose de 33 acides aminés dont un seul diffère du peptide original GLP-2 : la substitution de l'alanine par la glycine à l'extrémité N-terminale confère une résistance à la dégradation par l'enzyme dipeptidyl-peptidase IV, ce qui entraîne une prolongation de la demi-vie de l'analogue peptidique.
Comme le GLP-2, le téduglutide augmente l'absorption intestinale :
- en augmentation le débit sanguin intestinal et portal,
- en inhibant la sécrétion gastrique acide,
- et en diminuant de la motilité intestinale.
Place de REVESTIVE dans la stratégie thérapeutique
Selon l'avis de la Commission de la transparence de décembre 2014, REVESTIVE "peut être utilisé chez les patients ayant un syndrome du grêle court, après une phase d'adaptation de 6 à 12 mois en nutrition parentérale et pour lesquels les possibilités d'adaptation et d'hyperphagie compensatrice n'ont pas permis d'obtenir le sevrage de la nutrition parentérale".
La Commission recommande que " la prescription de REVESTIVE ne soit effectuée que par les praticiens des centres agréés de nutrition parentérale et après que toutes les mesures nécessaires à l'obtention d'un sevrage en nutrition parentérale aient été mises en œuvre".
Dans cet avis, la Commission s'est appuyée sur 2 études de phase III (Jeppesen PB and al.
Les deux études de phase III ont respectivement été conduite chez 83 patients et 86 patients, âgés de 48 ans et de 50 ans en moyenne, avec syndrome du grêle court (SGC) et sous nutrition parentérale depuis au moins 12 mois et 3 fois par semaine.
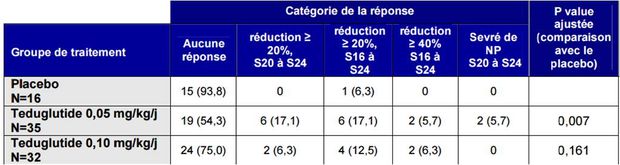
Le critère principal de jugement de l'étude de phase III de Jeppesen and al. a été le score de réponse algorithmique graduée prenant en compte l'intensité et la durée de la réponse (entre les semaines 16 et 20, puis 20 et 24).
La réponse au traitement était définie par une réduction d'au moins 20 % du volume de nutrition parentérale.
Bien que les résultats de ce score aient été en faveur du groupe teduglutide 0,05 mg/kg/jour (voir tableau I), ils n'ont pas pu être pris en compte du fait de l'absence de différence retrouvée entre le groupe teduglutide 0,10 mg/kg/jour et le placebo.
Tableau I - Résultats de l'étude de Jeppesen PB and al.
La positivité de ces résultats a été retrouvée dans l'étude de suivi correspondante : la réponse a été maintenue à 28 semaines pour 75 % des patients déjà traités par teduglutide (12 des 16 patients répondeurs du groupe teduglutide 0,05 et 6 des 8 patients répondeurs du groupe teduglutide 0,10).
Dans la 2e étude de phase III (Seidner DL and al. J Parenter Enteral Nutr. 2012 ; 36 :165), le critère de jugement principal était le pourcentage de répondeurs à la 20e semaine et à la 24e semaine.
La réponse au traitement était définie par une réduction d'au moins 20 % du volume de nutrition parentérale (NP).
Les résultats ont montré que le teduglutide à la dose de 0,05 mg/kg/jour a été supérieur au placebo, avec un taux de répondeurs à la 20e semaine maintenu à la 24e semaine de 63 % dans le groupe teduglutide versus 30,2 % dans le groupe placebo (p = 0,002).
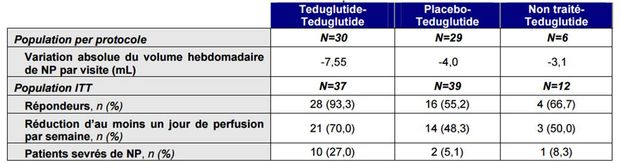
Dans l'étude de suivi (n = 88 patients), les résultats des critères d'efficacité à 24 mois ont été (Tableau II) :
Tableau II - Résultats des critères d'efficacité à 24 mois pour l'étude de suivi de Seidner DL and al. J Parenter Enteral Nutr. 2012 ; 36 :165 (d'après Avis de la Commission de la transparence - 3 décembre 2014)

Les critères de jugement et de comparaison avec le placebo n'ayant pas été hiérarchisés, ces résultats ont été qualifiés "de nature exploratoire" par la Commission de la transparence.
La Commission a regretté "l'absence de données sur la qualité de vie" dans la 2e étude de phase III et l'étude de suivi correspondante (Seidner DL and al. J Parenter Enteral Nutr. 2012 et Schwartz L and al. Am J Gastroenterol. 2013) "et de données sur la morbidité et la mortalité".
En termes de tolérance, le pourcentage d'événements indésirables liés au traitement par teduglutide a été de 37 % et de 55 % repectivement dans les 2 études de phase III, les plus fréquents ayant été des troubles gastro-intestinaux, des troubles liés à la rétention liquidienne et une septicémie liée au cathéter.
Un événement indésirable grave est survenu chez environ 1/3 des patients sous teduglutide, comme avec le placebo. Ces effets indésirables graves liés au traitement ont également été de nature gastro-intestinale principalement, dont 4 occlusions intestinales.
Considérant notamment qu'il n'existe pas d'alternative thérapeutique au teduglutide et que son rapport efficacité/effets indésirables est important, la Commission de la transparence a considéré que le service médical rendu (SMR) de REVESTIVE est important dans l'indication de son autorisation de mise sur le marché (AMM).
REVESTIVE en pratique
- Précautions préalables au traitement par REVESTIVE
Il est conseillé de réaliser une optimisation et une stabilisation des apports liquidiens et nutritionnels intraveineux avant de débuter le traitement.
Une coloscopie avec exérèse des polypes doit être effectuée au moment de l'instauration du traitement.
Au cours du traitement, des coloscopies (ou autres examens d'imagerie) de suivi sont recommandées :
- 1 fois par an au cours des 2 premières années de traitement ;
- au moins tous les cinq ans par la suite.
- Une administration sous-cutanée stricte
Après reconstitution, chaque flacon contient 5 mg de téduglutide dans 0,5 ml de solution, correspondant à une concentration de 10 mg/ml.
La posologie recommandée est de 0,05 mg/kg de poids corporel 1 fois par jour. A titre d'exemple, pour un patient de 70 à 73 kg, le volume à administrer est de 0,36 ml.
La solution reconstituée doit être administrée par injection sous-cutanée en alternant les sites entre les quatre quadrants de l'abdomen. La cuisse peut être utilisée si l'injection dans l'abdomen est difficile (douleur, cicatrices ou induration des tissus).
L'effet du traitement doit être évalué après 6 mois.
En l'absence d'amélioration de l'état général du patient, le traitement doit être arrêté en tenant du risque de déshydratation.
REVESTIVE doit être administré avec prudence aux personnes présentant une hypersensibilité connue à la tétracycline.
- Surveillance des patients
REVESTIVE expose à un risque cardiovasculaire de type insuffisance cardiaque ou hypertension. Il est important d'en informer les patients et de leur indiquer la démarche à suivre (consultation médicale recommandée) en présence des signes suivants :
- prise anormale de poids,
- oedème des chevilles,
- et/ou de dyspnée.
- Conditions de prise en charge
à condition que :
- la prescription soit effectuée par les praticiens des centres agréés de nutrition parentérale,
- et après que toutes les mesures nécessaires à l'obtention d'un sevrage en nutrition parentérale aient été mises en œuvre.
Identité administrative
- Liste I
- Prescription hospitalière réservée aux médecins compétents en nutrition, aux spécialistes et services d'hépatogastro-entérologie
- Boîte de 28 flacons + 28 seringues préremplies + 6 pistons, CIP 3400927722097
- Agrément aux collectivités (Journal officiel du 17 février 2015 - texte 31)
- Inscription sur la liste de rétrocession avec taux de remboursement à 65 % (Journal officiel du 17 février 2015 - texte 33 modifié par le Journal officiel du 16 septembre 2015 - texte 16) : pour ouvrir droit à une prise en charge, la prescription doit être effectuée par les praticiens des centres agréés de nutrition parentérale et après que toutes les mesures nécessaires à l'obtention d'un sevrage en nutrition parentérale aient été mises en œuvre ;
- Prix de vente HT par UCD aux établissements de santé = 646,214 euros (Journal officiel du 16 septembre 2015 - texte 89)
- Laboratoire Shire France
Pour aller plus loin
Résumé des caractéristique du produit de REVESTIVE (EMA, 10 septembre 2015)
Avis de la Commission de la Transparence (HAS, 3 décembre 2014)
Etudes citées dans l'article
- Jeppesen PB, Gilroy R, Pertkiewicx M et al. Randomised placebo-controlled trial of teduglutide in reducting parenteral nutrition and/or intravenous fluid requirements in patients with short bowel syndrome. Gut 2011;60:902-14.
- Seidner DL, Iyer KR, Joelsson B et al. Teduglutide, a novel analog of glucagon-like peptide 2, reduces parenteral volume in short bowel syndrome-intestinal failure subjects : results form a 24 week, placebocontrolled phase 3 trial. J Parenter Enteral Nutr. 2012;36:165.
- O'Keefe SJ, Jeppesen PB, Gilroy R et al. Safety and efficacy of teduglutide after 52 weeks of treatment in patients with short bowel intestinal failure. Clin Gastroenterol Hepatol 2013;11:815-23 (abstract)
- Schwartz L, O'Keefe SJ, Jeppesen PB and al. Long term safety and efficacy of teduglutide for the treatment of intestinal failure associated with short bowel syndrome : Final results of the STEPS-2 Study, a 2-year, multicenter, open-label clinical trial. Am J Gastroenterol. 2013;108:101.
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 9 minutes
9 minutes Ajouter un commentaire
Ajouter un commentaire


Commentaires
Cliquez ici pour revenir à l'accueil.